1 – Introdução
2 – Classificação dos processos cromatográficos
3 – Conceitos e parâmetros operatórios
3.1 - Resolução
4 – Modelo baseado na “teoria dos pratos”
5 – Modelos cinéticos
5.1 – Modelo de adsorção do tipo pistão difusional
Bibliografia citada
Bibliografia recomendada
1 – Introdução
A cromatografia é uma técnica de separação baseada na distribuição dos componentes de uma mistura entre um fluido (fase móvel ou eluente) e um adsorvente (fase estacionária). A fase estacionária pode ser um sólido ou um líquido depositado num sólido inerte, empacotado numa coluna ou espalhado por uma superfície formando uma camada fina.
A cromatografia de origem no termo grego “chroma+graphein” ganhou importância como método de separação por volta de 1903, com o botânico Mikhail Semenovich Tswett (Figura 1), nascido em Asti (Itália), sendo a sua família de origem russa. Este investigador desenvolveu vários trabalhos experimentais no domínio da separação de extractos de plantas por adsorção diferencial em colunas, usando carbonato de cálcio como fase estacionária e di-sulfureto de carbono como eluente (Figura 2). Nestas experiências, verificou-se a formação de bandas de cores diferentes nas colunas utilizadas devido à adsorção diferencial dos pigmentos corados, que percolavam com velocidades diferentes e emergiam separadamente da coluna. Este investigador foi mais tarde considerado o pai da cromatografia devido à sua valiosa contribuição no desenvolvimento desta técnica.
![Mikhail Semenovich Tswett [1]](images/stories/cromat1.jpg)
Figura 1 - Mikhail Semenovich Tswett [1]
![Unidades cromatográficas utilizadas por Tswett para a separação de pigmentos de plantas [1].](images/stories/cromat2.jpg)
Figura 2 - Unidades cromatográficas utilizadas por Tswett para a separação de pigmentos de plantas [1].
A cromatografia tem inúmeras aplicações como método de separação. Por exemplo, a cromatografia gasosa é utilizada para separar componentes relativamente voláteis como álcoois, cetonas, aldeídos e outros, enquanto que a cromatografia líquida é empregue normalmente para purificar produtos farmacêuticos, proteínas, aminoácidos, ácidos nucleicos, vitaminas e esteróides.
::: Início :::
2 – Classificação dos processos cromatográficos
As diferentes formas de cromatografia são classificadas de acordo com diversos critérios como se indica na Figura 3.
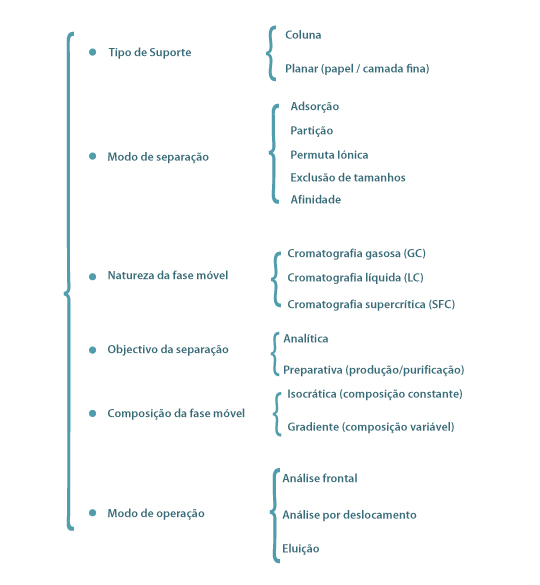
Figura 3 – Classificação da cromatografia
A classificação da cromatografia, segundo o modo de separação, tem em conta os princípios físicos e químicos subjacentes na partição dos solutos entre as 2 fases. Na cromatografia de adsorção as separações ocorrem através de interacções electrostáticas e forças de Van Der Waals entre a fase estacionária (sólido) e os componentes a separar da fase móvel (líquido ou gás). A natureza da fase estacionária pode ser muito diversa, nomeadamente sílica gel, alumina ou celulose. O fraccionamento por cromatografia de interacção hidrofóbica em coluna, sobretudo de misturas contendo espécies não iónicas solúveis em solventes orgânicos, é essencialmente determinado por diferenças de polaridade dos componentes na mistura a resolver. A cromatografia de partição é baseada nas diferenças de solubilidade dos componentes na fase estacionária (líquido) e na fase móvel (líquido). Na cromatografia de permuta iónica a separação ocorre devido diferentes tendências dos componentes iónicos ou ionizados permutarem com iões da fase estacionária, que, assim, são deslocados para a fase móvel. A afinidade entre os iões da fase móvel e o suporte pode ser controlada por alteração do pH e da força iónica do eluente. A cromatografia de exclusão molecular, denominada também como filtração em gel ou separação por peneiros moleculares, separa os componentes segundo o tamanho efectivo (raio hidrodinâmico) das moléculas, isto é, moléculas grandes não penetram no interior do suporte (partículas porosas de gel) e movem-se mais rapidamente ao longo da coluna de onde emergem primeiro, enquanto as moléculas pequenas vêm a sua velocidade de deslocamento retardada porque penetram no gel, portanto, emergem da coluna mais tardiamente. Na cromatografia de afinidade ocorre uma ligação molecular específica e reversível entre o soluto e um ligante imobilizado na fase estacionária. Esta técnica utiliza-se especificamente para separar produtos biológicos, e como exemplos podemos citar: ligações enzimas e substractos, anticorpos e substractos e recepetores de hormonas.
A cromatografia gasosa é uma técnica que permite a separação de substâncias voláteis arrastadas por um gás através de uma fase estacionária. A fase estacionária pode ser um sólido ou um líquido que propicia a distribuição dos componentes da mistura entre as duas fases através de processos físicos e químicos, tais como a adsorção, diferenças de solubilidades, volatilidades ou partilha. Como fase móvel é utilizado um gás, denominado gás de arraste, que transporta a amostra através da coluna cromatográfica até ao detector onde os componentes separados são detectados. Os gases mais utilizados são o hidrogénio, azoto, hélio e árgon. A cromatografia gasosa é usada em geral para fins analíticos. A cromatografia líquida é uma técnica adequada para a separação dos componentes (espécies iónicas, macromoléculas, constituintes termolábeis, …) de soluções líquidas e utiliza-se quer para fins analíticos quer para fins preparativos e em escala comercial. A amostra é injectada na coluna usando uma micro-seringa (na cromatografia analítica) ou uma válvula de injecção (em sistemas preparativos) e é homogeneamente distribuída no topo da coluna. A fase móvel transportando a amostra é forçada a percolar através da coluna por uma acção externa que pode ser a simples força da gravidade – cromatografia de baixa pressão – ou uma força mais intensa gerada por uma bomba – cromatografia de alta pressão também chamada cromatografia de alta precisão (HPLC) de modo a superar a resistência da coluna ao escoamento da fase móvel. No processo de percolação os componentes os componentes migram com velocidades diferentes e são identificados à saída da coluna num detector que fornece um registo contínuo da composição da amostra analisada - cromatograma. Os detectores mais usados são os fotométricos (VU), de fluorescência – sensíveis a espécies que fluorescem - e os de índice de refracção.
O enchimento da coluna cromatográfica (fase estacionária) é constituída por partículas porosas esféricas e pode suportar pressões que em HPLC podem ser superiores a 350 bar. Quando a fase estacionária é mais polar que a fase móvel, a cromatografia líquida é denominada de cromatografia de fase normal. Na situação inversa, ou seja, quando a fase estacionária apresenta menor polaridade que o solvente, a cromatografia recebe a denominação de cromatografia de fase reversa. Os adsorventes mais utilizados na cromatografia de fase normal são a sílica e a alumina, enquanto que para a fase reversa são empregues substâncias polares quimicamente ligadas, tendo como grupos funcionais cadeias com terminações do tipo ciano, diol, fenil , amino ou apolares. Os eluentes mais utilizados são: água, metanol e acetonitrilo.
Relativamente ao modo de operação, a técnica de uso mais corrente é a cromatografia de eluição. Nesta, o eluente flui continuamente através da coluna e a amostra a analisar é injectada rapidamente no eluente, à entrada da coluna. Os constituintes da amostra que se deslocam gradualmente através da coluna a velocidades diferentes, de acordo com os respectivos graus de afinidade em relação ao adsorvente, são progressivamente separados à saída coluna e, posteriormente, identificados como uma sucessão de “picos” num cromatograma.
Na análise por deslocamento a amostra é introduzida no topo da coluna e arrastada pela fase móvel contendo uma substância que apresente grande afinidade para a fase estacionária. Esta substância deve ser mais fortemente adsorvida que qualquer um dos constituintes da amostra, que vão sendo sucessivamente deslocados formando zonas de concentração constante. Deste modo, o perfil de concentração à saída da coluna tem a forma de um degrau. Na análise frontal, a amostra a analisar é introduzida continuamente no eluente. À medida que a fase móvel percorre a coluna, os constituintes vão-se distribuindo entre as duas fases e emergem da coluna em tempos diferentes quando o adsorvente fica saturado.
![Perfil de concentração do soluto na análise por eluição. Adaptado de [2].](images/stories/cromat4.jpg)
Figura 4 – Perfil de concentração do soluto na análise por eluição. Adaptado de [2].
::: Início :::
3 – Conceitos e parâmetros operatórios
O objectivo da cromatografia é, pois, separar ou “resolver” dois ou mais componentes de uma mistura. A Figura 5 tipifica um cromatograma no qual se identifica uma sucessão de “picos” correspondentes aos componentes separados, bem como algumas grandezas características de uma análise cromatográfica.
![Representação de um cromatograma. Adaptado de [2].](images/stories/cromat5.jpg)
Figura 5 – Representação de um cromatograma. Adaptado de [2].
As moléculas do soluto transportadas pela fase móvel têm tempos de retenção diferentes de acordo com os respectivos graus de adsorção na fase estacionária. O tempo de retenção ou tempo estequiométrico, tr, é o tempo que decorre entre o ponto de injecção até meia eluição (máximo do pico). De acordo com a teoria do movimento do soluto, o tempo de retenção é calculado através da equação,
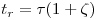 | (1) |
em que ζ é o factor de capacidade e o τ o tempo de passagem na coluna. O factor de capacidade é uma medida da velocidade com que um constituinte migra ao longo da coluna e é função do coeficiente de partição, k (admitindo equilíbrio linear), e da fracção de vazios na coluna, ε, ou seja,
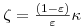 | (2) |
O coeficiente de partição k representa a constante de equilíbrio, sendo por isso dado pela relação,
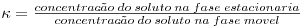 | (3) |
O volume de retenção 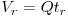 , onde Q é o caudal volumétrico, é o volume de eluente introduzido desde a injecção até meia eluição.
, onde Q é o caudal volumétrico, é o volume de eluente introduzido desde a injecção até meia eluição.
A resolução dos picos cromatográficos depende de dois parâmetros operatórios: a selectividade e a eficiência da coluna. Aumentando a selectividade da coluna, os picos afastam-se; aumentando a selectividade, os picos mantêm a distância entre eles mas tornam-se mais estreitos. Uma medida da selectividade corresponde à distância entre os máximos de dois picos e pode se exprimir pela relação,
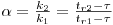 | (4) |
Para garantir que haja separação o valor de α deverá ser sempre superior a 1.
A eficiência de uma coluna é frequentemente expressa pela “altura equivalente a um prato teórico” (HETP), ou pelo número de pratos teóricos N = L /HETP. Define-se HTEP como a espessura de uma camada de coluna em que se admite existir equilíbrio instantâneo na partição das moléculas do soluto entre a fase estacionária e a fase móvel. Considerando que o pico cromatográfico representa uma distribuição aproximadamente gaussiana, N pode ser obtido por:
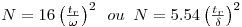 | (5) |
onde ω é a largura do pico na base (aproximando o pico a um triângulo – Figura 6) e δ é a largura a meia altura do pico.
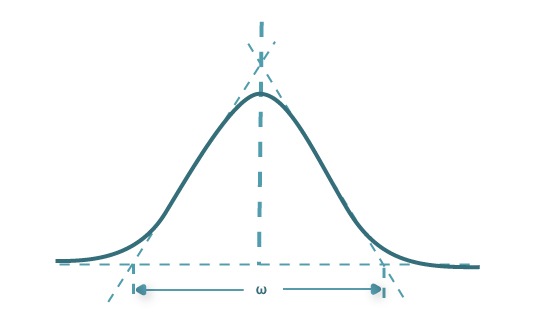
Figura 6 – Representação de um pico gaussiano.
::: Início :::
3.1 - Resolução
Para determinar a resolução de dois picos adjacentes, consideram-se as larguras dos picos Wi na linha de base, bem como os respectivos tempos de retenção tri de acordo com a equação,
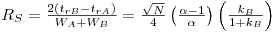 | (6) |
O valor deste parâmetro reflecte o grau de perfeição com que dois picos são separados, tendo em conta a contribuição da eficiência e da selectividade. O efeito da resolução no grau de separação dos picos está ilustrado na Figura 7. Para RS = 1.5, a separação é praticamente completa.
![O efeito na resolução na separação dos picos cromatográficos. Adaptado de [3].](images/stories/cromat7.jpg)
Figura 7 – O efeito na resolução na separação dos picos cromatográficos. Adaptado de [3].
::: Início :::
4 – Modelo baseado na “teoria dos pratos”
Este modelo baseia-se nas seguintes hipóteses:
a) Resistências à transferência de massa desprezáveis;
b) Equilíbrio instantâneo entre o soluto na fase móvel e o soluto adsorvido na fase estacionária;
c) O efluente flui continuamente através dos pratos;
d) Isotérmica do tipo linear.
O balanço ao soluto no prato i (Figura 8) pode então escrever-se como:
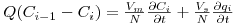 | (7) |
onde Vm e Vs são, respectivamente, os volumes da fase móvel e da fase estacionária em todos os pratos. Introduzindo a relação de equilíbrio e rearranjando a equação obtém-se,
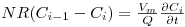 | (8) |
em que R é o factor de retenção definido de acordo com a equação seguinte
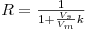 | (9) |
![Representação esquemática de uma coluna cromatográfica segundo a “teoria dos pratos”. Adaptado de [4].](images/stories/cromat8.jpg)
Figura 8 – Representação esquemática de uma coluna cromatográfica segundo a “teoria dos pratos”. Adaptado de [4].
Considerando as condições iniciais,
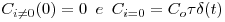 | (10) |
é possível obter uma solução da equação (8) na forma,
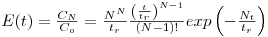 | (11) |
Para valores de N elevados, a equação (11) permite descrever um perfil de concentração à saída da coluna do tipo distribuição gaussiana, tal como se mostra na Figura 9.
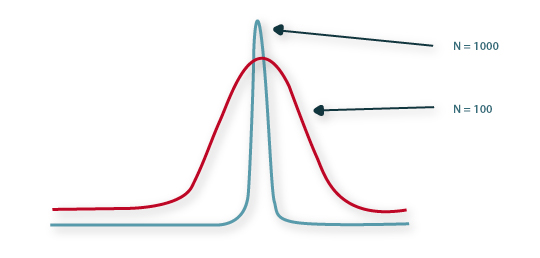
Figura 9 – Influência de N na resposta da coluna cromatográfica, E(t), face a uma entrada em impulso δ(t).
::: Início :::
5 – Modelos cinéticos
O modelo anterior possibilita uma descrição aproximada da separação cromatográfica. Contudo, não considera a contribuição de alguns mecanismos para a dispersão do pico, tais como: i) a dispersão axial das moléculas do soluto; ii) as resistências à transferência de massa no filme e nas partículas e iii) as condições de escoamento. Estes fenómenos que influenciam a migração do soluto através da coluna podem ser descritos por modelos matemáticos mais realistas, denominados modelos cinéticos. Um destes modelos, baseado em considerações estatísticas (“random walk model”), conduz à equação de Van Deemter,
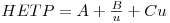 | (12) |
onde HETP representa a altura equivalente de um prato teórico e u a velocidade média da fase móvel. A, B e C são constantes, que representam contribuições devidas à dispersão turbulenta das moléculas do soluto, à difusão molecular e à resistência à transferência de massa, respectivamente.
A representação gráfica de HETP em função de u é mostrada na Figura 10. A constante B predomina para valores de u baixos, enquanto a constante C predomina para u elevados. A eficiência máxima da coluna é atingida operando com a velocidade óptima uopt = (B/C)1/2, correspondente à HETP mínima.
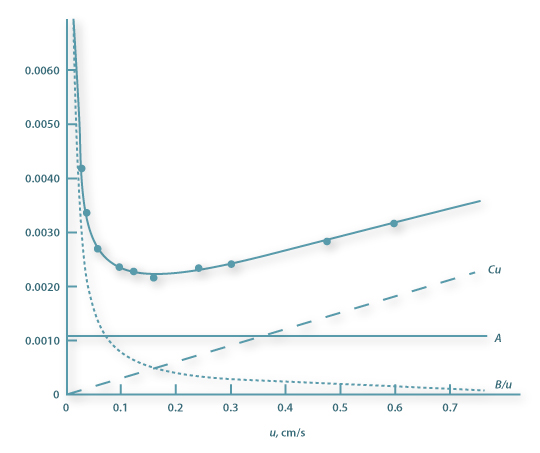
Figura 10 – Representação da equação de Van Deemter
::: Início :::
5.1 – Modelo de adsorção do tipo pistão difusional
Este modelo considera as seguintes equações:
a) Equação de balanço mássico à coluna;
b) Relação de equilíbrio aplicável à interface sólido-fluido;
c) Modelo cinético do tipo “força directriz linear”;
d) Condições aos limites do problema e condição inicial.
Um balanço mássico através de uma secção elementar de uma coluna de leito fixo, como a que se ilustra na Figura 11, conduz à seguinte equação,
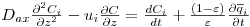 | (13) |
onde,
Ci = concentração do soluto i na fase fluida interparticular (kmol.m-3 de solução)
Dax = coeficiente de dispersão axial (m2.s-1)
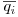 = concentração média do soluto i no adsorvente (kmol.m-3 de adsorvente)
= concentração média do soluto i no adsorvente (kmol.m-3 de adsorvente)
t = coordenada temporal (s)
ui = velocidade intersticial (m.s-1)
z = coordenada axial (m)
ε = porosidade interparticular
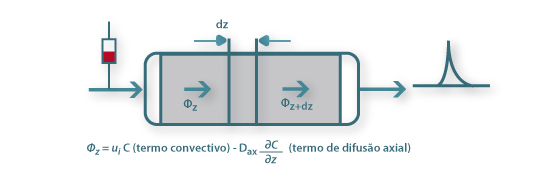
Figura 11 – Balanço de massa ao soluto num leito fixo.
Para o equilíbrio na interface líquido-sólido, considera-se como válida a isotérmica de Langmuir para sistemas multicomponentes, descrita de acordo com a equação,
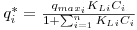 | (14) |
A velocidade de transferência do soluto da fase móvel para a fase estacionária pode expressar-se em termos de um coeficiente de transferência ksi e de uma força directriz 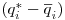 :
:
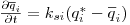 | (15) |
em que ksi pode ser estimado através da correlação[5]:
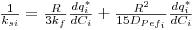 | (16) |
em que,
Dpef é o coeficiente de difusão efectiva (m.s-2) = εp Dm /τp; Dm é o coeficiente de difusão molecular, εp é a porosidade intraparticular e τp o factor de tortuosidade que normalmente varia entre 2 e 6. Existem correlações na literatura para estimar Dm e o coeficiente de transferência de massa no filme kf.
As condições iniciais e aos limites necessárias à integração das equações (13) – (15) são:
- Condições iniciais
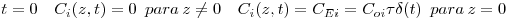 | (17) |
- Condições aos limites
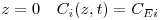 | (18) |
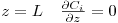 | (19) |
A dispersão axial do soluto através da coluna pode ser estimada pela correlação de Butt[6]:
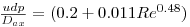 | (20) |
sendo:
onde,
dp = diâmetro das partículas (m)
u = velocidade superficial (m.s-1)
ρf = massa específica da solução (kg.m-3)
η = viscosidade da solução (Pa.s)
As equações apresentadas para o modelo de adsorção do tipo pistão difusional foram utilizadas para simular o caso de estudo “separação cromatográfica da mistura fenol e m-cresol”.
::: Início :::
Bibliografia citada
[1] - L. S. Ettre, “M.S. Tswett and the invention of chromatography”, LCGC North America, 21 (2003) 458-467.
[2] – Raymond P. W. Scott, “Principles and Practice of Chromatography”, Chrom-Ed Book Series (2003), http://www.library4science.com/
[3] - Garret, J.S., “Introduction to Chromatographic Separations”, On-line Course (CEM333) in Michigan State University (2000)
[4] – F. A. P. Garcia and E. M. V. Pires, “Chromatography”, Recovery Processes for Biological Materials, edited by J.F. Kennedy and J. M. S. Cabral (1993) 415-451.
[5] – Farooq, S. and Ruthven, D. M., “Heat effects in adsorption column dynamics: 2. experimental validation of the one-dimensional model”, Industrial & Engineering Chemistry, 29 (1990) 1084.
[6] – Butt, J. B., “Reaction Kinetics and Reactor Design”, Prentice-Hall: Englewood Cliffs (1980), 274.
::: Início :::
Bibliografia recomendada
Coulson, J.M. and Richardson, J.F., “Chemical Engineering”, Vol. III, Pergamon Press, 1985
Ladisch, M. R., “Bioseparations Engineering: Principles, Practice, and Economics”, John Wiley & Sons (2001)
Sofer, G.K. and Nystrom, L.E., “Process Chromatography – A Pratical Guide”, Academic Press, London (1989).
Wankat, P.C., “Rate-Controlled Separations”, Blackie Academic & Professional, London, 1994
::: Início :::








