Experiência 1: Determinação da Constante Cinética e da Energia de Activação da Reacção Homogénea em fase Líquida do Acetato de Etilo com o Hidróxido de Sódio
Introdução Teórica
Modo de Proceder
Ilustração do tratamento de resultados experimentais
Caso de Estudo
Cuidados Especiais
Materiais
Deposição de Resíduos
Relatório Modelo
Referências
1. Introdução Teórica:
O objectivo deste trabalho prático é a determinação da constante cinética e da energia de activação da reacção de segunda ordem entre o hidróxido de sódio e o acetato de etilo (AcE), pelo método integral.
A reacção de saponificação do acetato de etilo:
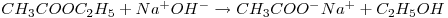 | (1) |
é de primeira ordem relativamente a cada um dos reagentes:
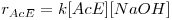 | (2) |
sendo a constante cinética a 20ºC k = 7,41 x 10-5m3mol-1s-1, e a energia de activação E=49724 Jmol-1 (1).
O acetato de etilo é altamente inflamável e os seus vapores não devem ser respirados. É parcialmente solúvel em água, sendo possível obter soluções de 0,2 M à temperatura ambiente. Estas soluções perdem rapidamente o seu título inicial por evaporação fraccionária do componente mais volátil.
A concentração do acetato de sódio pode ser seguida por condutimetria. A condutância eléctrica é o inverso da resistência e tem unidades de Ω-1, habitualmente designado por S (siemen). A condutância eléctrica de uma solução G é a medida da sua capacidade de conduzir a corrente eléctrica. Na medição da condutância eléctrica duma solução, é habitual usarem-se dois terminais de platina (eléctrodos) separados duma dada distância e tendo uma dada área. A resistência à passagem de corrente eléctrica R entre estes dois terminais é inversamente proporcional à sua área e directamente proporcional à distância entre eles. Chama-se resistividade ou resistência específica à resistência dividida pela área dos terminais e multiplicada pela distância entre eles:
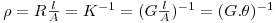 | (3) |
Sendo ρ a resistência específica, l a distância entre os dois terminais, A a área dos terminais, K a condutância específica ou condutividade e θ=l/A a constante do eléctrodo de condutividade. A condutividade vem normalmente expressa em Scm-1 ou Sm-1(Sm-2m). Numa solução apenas os iões conduzem a corrente eléctrica. Para soluções diluídas de um ião, a condutância é proporcional à sua concentração. A condutância duma solução contendo vários iões é obtida, para soluções diluídas, adicionando as diferentes condutâncias:
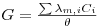 | (4) |
sendo λm,i a condutância específica molar do componente i.
A constante do eléctrodo θ pode ser obtida por comparação da condutividade lida por esse eléctrodo, duma solução de referência, normalmente uma solução de KCl, e a sua condutividade efectiva:
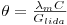 | (5) |
onde λm é a condutividade molar do electrólito e C a sua concentração. No caso do electrólito ser o cloreto de potássio, a sua condutividade molar encontra-se tabelada para diferentes temperaturas e concentrações (ver e.g. Tabela 1).
Existem tabelas contendo as condutividades molares de diferentes iões a diluição infinita (λm∞) (2). Uma vez que durante a reacção de saponificação em estudo há o desaparecimento de um ião (OH-) e o aparecimento de outro (CH3COO-) com condutividades molares muito diferentes, seria em princípio possível acompanhar a conversão da reacção através da equação:
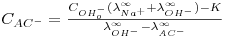 | (6) |
já que as condutividades molares a diluição infinita de todos os reagentes e produtos existem tabeladas. Entretanto, verifica-se que mesmo para concentrações de 0,1 M de hidróxido de sódio ou de acetato de sódio, estas constantes apresentam um erro importante. Assim, teremos de encontrar um procedimento alternativo de calibração do método de análise que nos permita seguir a conversão da reacção em estudo com uma maior exactidão.
Esse método passa por medir a condutividade molar dos diferentes iões, numa região próxima das concentrações de trabalho. Assim, começa-se por medir a condutividade (K0) duma solução de hidróxido de sódio com concentração CNaOH, igual à concentração inicial a usar na reacção de saponificação. Isto permite-nos ter acesso à condutividade molar dos iões hidróxido de sódio e, assumindo dependência linear com a concentração, traçar a curva da condutividade em função da concentração em hidróxido de sódio (linha 1 na Figura 1).
De seguida, mede-se a condutividade do produto da reacção, para reacção completa (K∞), acedendo assim à condutividade molar dos iões acetato e sódio. Para garantir conversão total (ou aproximadamente total), deverá usar-se um excesso de 10 a 20% molar de um dos reagentes, relativamente à quantidade estequiométrica. Seja esse reagente o acetato de etilo. Através da estequiometria da reacção e das concentrações iniciais dos reagentes, é possível calcular a concentração final em acetato de etilo:
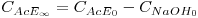 | (7) |
sendo CAcE0 e CNaOH0 as concentrações iniciais de acetato de etilo e de hidróxido de sódio. Note que a condutividade do acetato de etilo é nula (composto não iónico) e da água é desprezável (<2μScm-1).
Com estes dois pontos, traça-se a curva de calibração, que deverá ter a seguinte forma (linha 2):
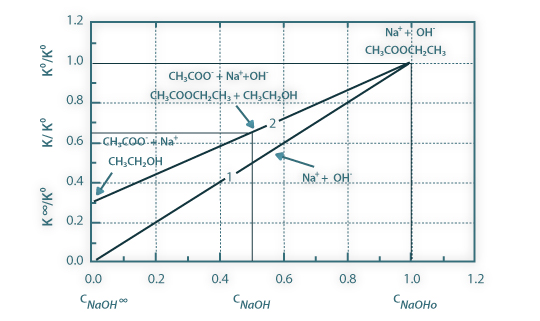
Figura 01: Curva de calibração do método de análise (2) - condutividade adimensional da solução reaccional em função da concentração não convertida de hidróxido de sódio - e curva da condutividade adimensional da solução de hidróxido de sódio em função da concentração (1). Condutividades em unidades de μScm-1.
A equação da curva de calibração da condutividade da solução reaccional em função da concentração de hidróxido de sódio presente vem, assim:
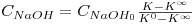 | (8) |
Uma vez que a reacção obedece a uma estequiometria conhecida, é fácil agora obter a concentração de acetato de etilo:
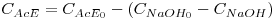 | (9) |
Ou, em termos de conversão de hidróxido de sódio (reagente limitante):
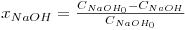 | (10) |
Neste modo de proceder está implícito que a condutividade do meio reaccional varia linearmente com a conversão, dentro dos limites de concentração considerados.
Alternativamente à calibração poderemos usar a equação (6), substituindo as condutividades molares a diluição infinita pelas correspondentes para a gama de concentração de trabalho:
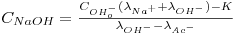 | (11) |
onde, para o presente trabalho [3]:
vindo a temperatura T em graus celsius.
Para se obter a constante cinética duma reacção, é condição suficiente conhecer a variação da conversão em função do tempo de reacção num reactor fechado. Até aqui descrevemos como podíamos seguir a concentração dos reagentes ao longo do tempo, ou, equivalente, da conversão, uma vez que estas quantidades estão directamente relacionadas. Vamos agora descrever como podemos medir a constante cinética pelo método integral a partir da história da conversão.
Resolvendo a equação de balanço material para um reactor fechado e uma reacção de segunda ordem obtemos [4]:
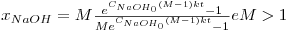 | (12) |
Sendo M=CAcE0/CNaOH0. Para M=1, esta equação vem, simplesmente,
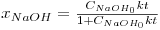 | (13) |
Para uma concentração inicial em acetato de etilo de 0,125 M e em hidróxido de sódio de 0,100 M (M=1,25), o gráfico xNaOH em função do tempo é apresentado na figura 2:
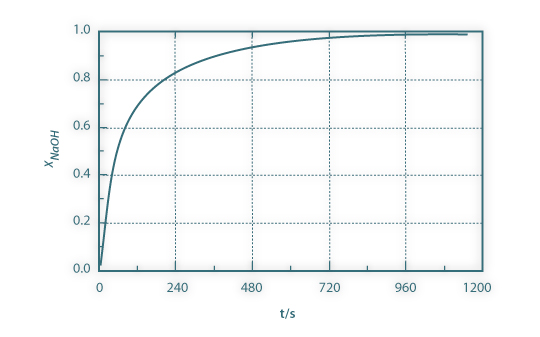
Figura 02: Conversão do hidróxido de sódio em função do tempo para k=1.1x104 m3mol-1s-1 e M = 1.25.
A determinação da constante cinética k pelo método integral é feita a partir da curva
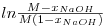 | (14) |
em função do tempo [4]. A inclinação da recta de ajuste é CNaOH0(M-1)k, donde a constante cinética pode ser obtida como:
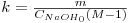 | (15) |
sendo m a inclinação da recta de ajuste.
O parâmetro cinético pode ainda ser obtido com vantagem, por ajuste não linear da equação (12) ou (13) ou simplesmente, aos resultados experimentais recorrendo a algoritmos existentes em programas comerciais como o MS Excel®, que fazem a minimização do somatório do quadrado dos resíduos.
Chama-se a atenção de que os pequenos erros na calibração do método de análise podem originar grandes desvios no gráfico
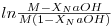 | (16) |
em função do tempo, para conversões elevadas. Na figura 3 são apresentadas três curvas: as curvas superior e inferior correspondem à introdução de um erro constante na conversão: xNaOH=xNaOH±0.01. Assim não devem ser considerados os resultados para conversões elevadas. A estes resultados poderá estar associado um erro importante.
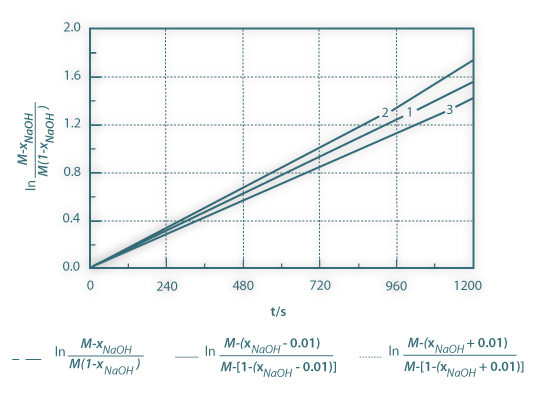
Figura 03: Método integral para a obtenção da constante cinética de uma reacção de segunda ordem. A inclinação da curva é CNaOH0(M-1)k. Curvas 2 e 3 – introdução de um erro de ±0.01 na conversão do hidróxido de sódio ; Curva 1- curva original, sem erro.
A influência da temperatura na cinética de uma reacção é determinada pela energia de activação dessa reacção através da lei de Arrhenius:
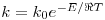 | (17) |
Onde k0 é o factor de frequência, E é a energia de activação, ℜ é a constante dos gases perfeitos e T é a temperatura absoluta.
Dispondo da constante cinética a três temperaturas diferentes, por exemplo 15ºC, 20ºC e 25ºC, por ajuste à lei de Arrhenius podemos obter o valor da constante de frequência (k0) e da energia de activação (E):
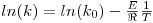 | (18) |
Uma energia de activação muito elevada traduz uma sensibilidade muito grande da cinética em relação à temperatura. Nestes casos é preciso muito cuidado no controlo e medição da temperatura.
De novo, a constante de frequência e a energia de activação podem ser estimadas com vantagem recorrendo ao ajuste não linear da equação (17) aos resultados experimentais [5].
2. Modo de proceder:
Verifique se a instalação está de acordo com a Figura 4. Esta figura traduz o arranjo necessário à determinação da constante cinética da reacção química em estudo. Verifique ainda se o eléctrodo está convenientemente ligado e limpo e a sua constante correctamente introduzida no condutímetro. Verifique o fecho das cabeças da bomba peristáltica.
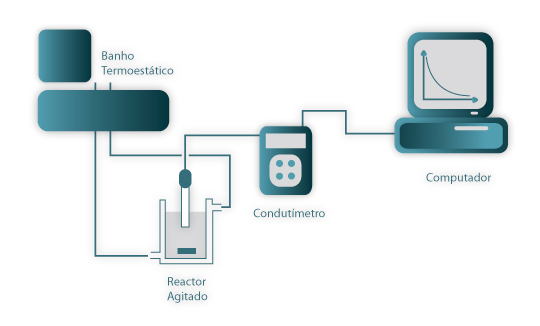
Figura 04: Esquema da montagem experimental
Na preparação de todas as soluções para esta experiências, deverá ser sempre usada água destilada e desionizada.
Como se pretende obter a energia de activação da reacção, tem que se operar com o reactor químico a diferentes temperaturas. Assim, a constante cinética da reacção deverá ser estimada experimentalmente a, pelo menos, três temperaturas diferentes. Uma vez que se dispõe de um banho com aquecimento e arrefecimento, iremos obter a constante cinética a 15ºC, 20ºC e 25ºC.
Nota – O limite mínimo de temperatura para obtenção da constante cinética prende-se com o facto desta reacção ser muito lenta abaixo dos 15ºC. O limite máximo de 25ºC prende-se, por um lado, com a perda de reagentes por evaporação (especialmente o acetato de etilo) e por outro devido ao facto de a reacção passar a ser tão rápida vindo a precisão dos resultados comprometida. O passo escolhido, 5ºC, tem a ver com o passo maior que verifique os limites impostos anteriormente.
O banho termostático disponível possui uma inércia térmica de arrefecimento muito grande. Deste modo, deverá liga-lo de imediato e regular a sua temperatura para 15ºC.
A condutividade duma dada solução dum electrólito varia com a temperatura. Desta forma os condutímetros dispõem duma função de compensação automática da temperatura devendo apresentar um valor de condutividade correspondente à temperatura de 20°C. O problema é que a sensibilidade da condutividade de diferentes soluções à temperatura é diferente e o condutímetro não faz essa distinção. Desta forma deverá determinar K° e K∞ para cada uma das temperaturas de reacção e construir uma curva de calibração para cada temperatura, figura 1.
Prepare agora 500 cm3 duma solução de hidróxido de sódio aproximadamente 0,2 M, mas de título rigoroso, a partir da solução titulada 1M. Verta 100,0 cm3 da solução preparada no reactor, acrescente 100,0 cm3 de água destilada e ligue o agitador magnético. Registe a condutividade. A esta condutividade deverá corresponder uma concentração em hidróxido de sódio metade da original, ou seja, aproximadamente 0,1 M. Esta é precisamente a condutividade inicial, K°.
Nota – Para medir rigorosamente 90 cm3 de volume poderá usar uma pipeta de 50 cm3 e uma pipeta de 20 cm3, usando esta última duas vezes ou, alternativamente, pode usar uma pipeta de 100 cm3 e depois retirar 10 cm3 de solução com uma pipeta de 10 cm3. Para os objectivos do presente trabalho é suficiente medir 100 cm3 da NaOH 1 M com uma pipeta volumétrica e dilui-la num balão volumétrico de 500 cm3, uma vez que embora o título da solução diluída deva ser rigoroso, a sua concentração final não tem que ser exactamente 0,2 M.
Lave agora o reactor com água destilada. Introduza 100,0 cm3 da solução preparada de hidróxido de sódio num matraz de 150 cm3, anteriormente passado por esta solução (porquê?), feche-o bem e coloque-o no banho termostático até ao equilíbrio térmico. Adopte um procedimento semelhante relativamente à solução titulada de acetato de etilo 0,25 M, disponível. Esta contém índigo de carmim (0,005% p/p), um indicador ácido-base não tóxico e com uma zona de viragem entre 11,5 e 13,0 de pH, passando de uma cor azul –carregado a amarelo. A solução de acetato de etilo é, assim, azul.
Nota - Se a solução preparada de hidróxido de sódio exceder a concentração de 0,2 M sugerida, a cor do meio reaccional poderá não mudar o suficiente para ser visível, i.e., o pH da solução pode manter-se sempre superior a 12. Faça os cálculos para se certificar que está a usar uma concentração tal que vai obter uma mudança de cor do meio reaccional.
Nota - A solução de acetato de etilo com o índigo de carmim é instável. Ao fim de algum tempo a cor azul do índigo de carmim começa a desvanecer-se e a conversão da reacção que deverá ser possível acompanhar qualitativamente através de mudança de cor do indicador deixa de ser possível. O índigo de carmim deverá passar de verde-escuro (porquê), no início da reacção, para verde mais claro e depois azul, já no final da reacção. Assim, verifique sempre a data de preparação da solução de acetato de etilo. Esta não deveria ter mais de 4 dias.
Verta a solução de hidróxido de sódio no reactor, ligue o agitador magnético e coloque o termómetro acima deste e leia a temperatura do meio reaccional, verificando a sua estabilidade. Retire o termómetro e introduza o eléctrodo de condutividade do meio reaccional. Ligue o registo da condutividade no computador.
O acetato de etilo evapora-se rapidamente, sobretudo a temperaturas acima de 20ºC, alterando o título da solução. Deve-se ter por isso cuidado na sua manipulação quando a temperatura da solução estiver acima desta temperatura.
Junte rapidamente os 100 cm3 da solução de acetato de etilo ao reactor e anote o tempo em que essa adição ficou completa. A reacção tem início neste momento. A solução reaccional deverá adquirir uma cor verde (porquê?) que se vai esbatendo ao longo do tempo até regressar ao azul-escuro inicial. Mantenha sempre a tampa no reactor de forma a diminuir a evaporação do acetato de etilo. Após cerca de 20 min de reacção, termine a experiência e transfira o meio reaccional para um gobelé e tape-o. Deixe que a reacção continue até à conversão completa do hidróxido de sódio (xNaOH > 99%), a que deverá corresponder uma condutividade constante com o tempo, (K∞). A partir deste momento não tem importância que a temperatura suba para a temperatura ambiente, uma vez que estamos interessados na condutividade para conversão total e não na cinética. Registe a condutividade (K∞) correspondente. Este dado é essencial para traçar a curva de calibração.
Use agora as equações (8) e (10) para obter a curva de conversão em função do tempo. Seguidamente, trace a curva.
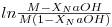 | (19) |
em função do tempo e obtenha a constante cinética. Alternativamente, ou cumulativamente, poderá usar a equação (11), também proposta no texto, para seguir a concentração do acetato ao longo da experiência.
Registe a temperatura do meio reaccional no início, a meio e no fim da reacção.
Nota - Qual o procedimento mais adequado: medir rigorosamente 100,0 cm3 de AcE com uma pipeta ou balão volumétrico e verter directamente para o reactor, ou transferir este volume para um pequeno copo, previamente passado pela solução, e deste para o reactor. Porquê?
Nota - Admita que inicialmente verte no reactor, sobre a solução de AcE, apenas metade da solução de NaOH e só mais tarde o resto. Quando, durante o tratamento dos resultados, coloca em gráfico ln(M-xNaOH)/(M(1-xNaOH)) em função do tempo, a inclinação da segunda parte da curva dá directamente a constante cinética da reacção (k=m/(CNaOH(M-1)))? Para responder a esta questão, represente numa folha de cálculo ln(M-xNaOH)/(M(1-xNaOH)) em função do tempo, atribuindo a k um valor razoável (p. ex., 0,2). Construa, depois uma nova folha, agora com ln(M-xNaOH)/(M(1-xNaOH)) em função de t, sendo k metade do valor anterior até cerca de metade do tempo final escolhido (p. ex., tmax = 50), e a partir deste tempo o valor originalmente atribuído a k. Compare as duas curvas graficamente e determine por ajuste os valores da constante cinética correspondente às duas porções da curva.
Repita agora a experiência para as temperaturas de 20ºC e 25ºC, mas uma vez que já dispõe da curva de calibração do método de análise não necessita de obter K∞ novamente. Lave o reactor e o eléctrodo com água destilada entre cada experiência.
Nota - As temperaturas mais elevadas induzem uma maior evaporação do acetato de etilo presente em solução. De que forma a medição da constante cinética vem alterada?
No final deverá lavar o reactor e o eléctrodo com água. Deverá ainda deixar o eléctrodo mergulhado em água destilada.
Todas as medições experimentais vêm afectadas de um erro, o erro experimental. Faça uma análise de sensibilidade para determinar onde os erros experimentais afectam mais significativamente os resultados. Por exemplo, será que a variação de 1ºC na temperatura do meio reaccional afecta significativamente a medição da constante cinética? Para isso precisa de saber, ou ter, uma estimativa, da energia de activação da reacção e fazer uma análise de sensibilidade. Se a constante cinética for muito sensível à temperatura deveremos ter muito cuidado no seu controlo. Na preparação do trabalho faça um estudo de sensibilidade às principais variáveis que afectam o cálculo da constante cinética e da energia de activação.
Dados dos eléctrodos de condutividade (estes dados podem ser alterados por calibração posterior):
- Constante do eléctrodo de condutividade – 113,4 S m-1;
- Constante de compensação da temperatura do condutímetro para uma solução de hidróxido de sódio aproximadamente 0,1 M – 2,000%/°C;
- Constante de compensação da temperatura do condutímetro para uma solução de acetado de sódio aproximadamente 0,1 M – 2,000%/°C.
3. Ilustração do tratamento de resultados experimentais:
Os seguintes resultados experimentais não pretendem ser reais, são antes os dados necessários à ilustração do tratamento matemático que se pretende fazer.
Na Figura 5 podemos ver uma fotografia do reactor fechado em operação. Na figura 5 a) a cor do meio reaccional é verde, devido ao facto do pH ser elevado (elevada concentração de hidróxido de sódio). Na figura 5 b) a cor do meio reaccional é azul, indicando um pH mais baixo (menor concentração de hidróxido de sódio). Na Tabela 1 são apresentados os dados operatórios.

a) b)
Figura 05: Fotografia do reactor fechado: a) no início da reacção; b) no final da reacção
Tabela 1 - Dados operatórios
| Ensaio | Temperatura do meio reaccional (ºC) | Concentração de partida da solução de NaOH (M) | Concentração inicial da solução de AcE (M) | Condutividade da solução de NaOH com metade da concentração inicial(mS cm-1) | Condutividade K∞ da solução reaccional para tempo muito elevado(mS cm-1) |
| 1 | 15,0 | 0,20 | 0,25 | 19,53 | 6,30 |
| 2 | 20,0 | 0,20 | 0,25 | 19,15 | 6,39 |
| 3 | 25,0 | 0,20 | 0,25 | 19,10 | 6,47 |
Na Figura 6 são apresentados os resultados experimentais da condutividade do meio reaccional em função do tempo para as três temperaturas de operação e na Figura 7 a conversão linearizada do acetato de etilo, juntamente com as curvas de ajuste, em função do tempo e para as mesmas três temperaturas consideradas. Da inclinação das curvas de ajuste obtêm-se as constantes cinéticas aparentes relativas às três temperaturas consideradas. Na Figura 8 os valores obtidos das constantes cinéticas são apresentados em função do inverso da temperatura absoluta. Esta representação permite-nos obter a energia de activação e o factor de frequência relativos à reacção estudada.
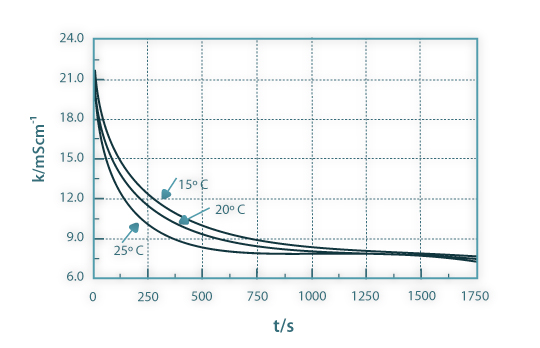
Figura 06: Condutividade em função do tempo para as temperaturas de 15ºC, 20ºC e 25ºC.
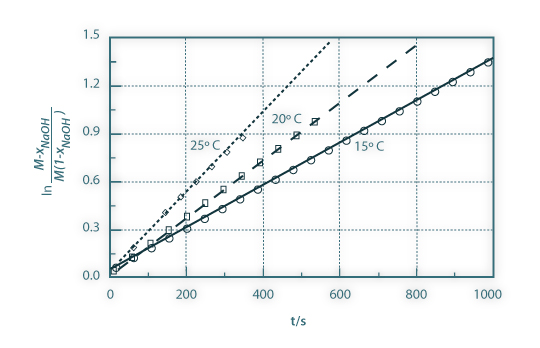
Figura 07: Linearização da conversão do hidróxido de sódio em função do tempo (pontos - representados apenas um em cada 20 pontos experimentais e curvas de ajuste relativas às temperaturas de 15ºC, 20ºC e 25ºC.
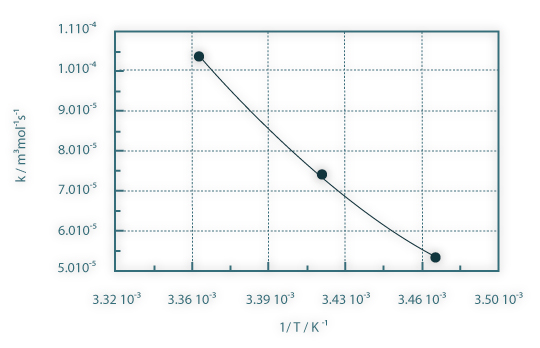
Figura 08: Constante cinética em função do inverso da temperatura absoluta.
Tabela 2 – Valores das constantes cinéticas obtidas para concentrações iniciais de hidróxido de sódio e acetato de etilo de 0.100 M e 0.125 M, respectivamente.
| Constante Cinética | 15ºC | 19.5ºC | 24.5ºC |
| k (m3mol-1s-1) | 5.335x10-5 ± 8.773x10-6 | 7.406x10-5 ± 4.633x10-6 | 1.035x10-4 ± 8.439x10-6 |
4. Caso de estudo:
De seguida são apresentadas tabelas com valores experimentais discriminados de tempo, condutividade e conversão de hidróxido de sódio para as três temperaturas em estudo.
Temperaturas 15ºC
Temperaturas 20ºC
Temperaturas 25ºC
O tempo de adição do reagente, para cada uma das experiências foi:
t (adição, 15ºC) = 1103,5 s
t (adição, 20ºC) = 18,1 s
t (adição, 25ºC) = 18,0 s
E os valores de:
K0 = 23,38 mS cm-1
K¥ = 7,35 mS cm-1
Com estes dados, pode agora reproduzir os cálculos efectuados na secção anterior e aferir os seus conhecimentos em relação a esta matéria.
5. Cuidados especiais:
O acetato de etilo é altamente inflamável. Tomar cuidado com possíveis fontes de ignição, tais como: corrente eléctrica, superfícies muito quentes ou chama.
Embora não sendo considerado tóxico, evitar respirar os vapores do acetato de etilo.
O índigo de carmim é perigoso e por isso devem ser tomadas medidas de segurança necessárias aquando da sua manipulação.
As seguintes recomendações devem ser seguidas:
- usar luvas de borracha;
- usar óculos de protecção enquanto a manipulação de soluções perigosas;
- antes de abrir um frasco de reagente, ler o rótulo;
- não brincar com os reagentes.
Verifique sempre antes de começar o trabalho experimental, se a banca está limpa e livre de material sujo ou desarrumado. Limpe a banca e arrume o material, se for caso disso.
Deixe sempre a banca arrumada. Tenha especial cuidado em não deixar recipientes com soluções na banca de trabalho, nem material sujo.
Etiquete todos os recipientes utilizados, usando etiquetas ou um marcador. Note que é fácil confundir um gobelé com água com um contendo ácido clorídrico. No final, retire as etiquetas e coloque o material para ser lavado.
Um dos maiores inimigos da segurança é o cansaço. Um operador cansado relaxa as normas de segurança e tem reflexos mais lentos. O acidente pode então acontecer a qualquer momento. Preste atenção às normas de segurança. Estas poderão evitar-lhe acidentes no presente e no futuro!!!
6. Materiais:
Material de vidro/ plástico:
- 1 funil médio;
- 2 gobelés 100 cm3;
- 3 gobelés 500 cm3;
- 1 gobelé 1000 cm3;
- 2 matrazes de 150 cm3;
- 1 proveta 50 cm3;
- 1 balão 500 cm3;
- 1 pipeta 10 cm3;
- 3 pipetas 100 cm3.
Outro material:
- 1 rolo papel absorvente;
- etiquetas e marcador;
- esguicho;
- pompete;
- 1 termómetro
- 1 barra magnética pequena
- 1 par óculos de protecção
- 1 cronómetro
7. Deposição de resíduos:
Os resíduos de hidróxido de sódio produzidos nesta experiência deverão ser depositados no reservatório correspondente, que deverá existir no laboratório.
O acetato de etilo, em princípio, deverá encontrar-se totalmente convertido em acetato de sódio, um sabão não tóxico e biodegradável. O indicador usado, o índigo de carmim, também é biodegradável nas concentrações usadas. Assim, estes reagentes poderão ser eliminados através do esgoto.
Relatório Modelo
Determinação da Constante Cinética e da Energia de Activação da Reacção Homogénea em fase líquida do Acetato de Etilo com o Hidróxido de Sódio
::: Início :::
Referências
[1] Manual dos Laboratórios de Engenharia Química da Universidade de Nancy, França, 1994.
[2] Braun, R. D., “Introduction to instrumental Analysis”, McGraw-Hill, NY, 1987.
[3] Manual dos Laboratórios de Engenharia Química da Universidade de Cambridge, UK, 1994.
[4] Levenspiel, O., “Engenharia das Reacções Químicas, vol. 1: Cinética Química Aplicada”, Edgard Blucher, SP, 1974.
[5] Chen, N. H.; Aris, R., “Determination of Arrhenius Constants by Linear and Non Linear Fitting”, AIChE J., 38, 626-628, 1992.
in:
- Mendes, A., “Laboratórios de engenharia Química – Reactores em Fase Homogénea, Reactores Catalíticos, Separações não Convencionais e Tecnologia de Sólidos Divididos”, FEUP- Edições, 16 capítulos, 2002








