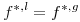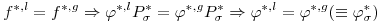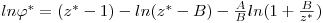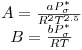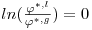Vaporização e pressão de vapor das substâncias puras
Determinacão de equilíbrio líquido-vapor (ELV) de substâncias puras pelas fugacidades
Referências
Vaporização e pressão de vapor das substâncias puras
Designa-se por vaporização o processo segundo o qual um líquido é convertido no vapor. Na fase líquida as forças intermoleculares mantêm a substância como um todo coeso. À medida que a temperatura aumenta as moléculas movem-se cada vez mais vigorosamente, havendo um número cada vez maior de moléculas com energia suficiente para se libertar da interação das suas vizinhas. A vaporizaçãoserá, portanto lenta a baixa temperatura e mais rápida às temperaturas elevadas.
Sabe-se que os líquidos voláteis se evaporam mais fácilmente (mais rápidamente) que outros à mesma temperatura. Nesses líquidos as forças intermoleculares serão comparativamente mais fracas. Regra geral a velocidade de evaporação depende da intensidade das forças intermoleculares e da velocidade de fornecimento de calor à fase líquida.
http://www.chm.davidson.edu/ronutt/che115/Phase/Phase.htm
A vaporização é um processo endotérmico (deve ser fornecido calor ao líquido) para que as moléculas possuam energia suficiente para vencer as forças intermoleculares. Assim, a entalpia (molar) de vaporização (designada também por calor latente de vaporizaçao) é a quantidade de calor necessária para a evaporação de uma mole de líquido a uma dada temperatura (e à correspondente pressão de vapor).
Num vaso aberto as moléculas escapam-se da superfície do líquido para a atmosfera. Num vaso fechado onde se tenha efectuado o vazio, a situação é diferente: a vaporização do líquido vai tendo lugar até que a certa altura, quando a pressão no interior do vaso atinge um valor máximo, as moléculas regressam à fase líquida de tal modo que a velocidade de retorno ao líquido é igual à velocidade de vaporização. Quer dizer, nesta situação está estabelecido um equilíbrio dinâmico entre o líquido e o seu vapor em que a vaporização e a condensação ocorrem à mesma velocidade. A pressão em tal vaso (fechado) designa-se por pressão de vapor Pσ* e o seu valor é função da temperatura (T). Num vaso aberto para a atmosfera o líquido entra em ebulição quando a pressão de vapor é igual à pressão ambiente ( de 1 atm) que está exercida sobre a superfície do líquido. Nestas condições falamos em ebulição normal. O ponto de ebuliçao normal é assim, o ponto (especial) da curva de vaporização de uma substância pura onde (T= Tb e Ps =1 atm) e a curva de vaporização é, em si mesma, uma sequência infinita de pontos (T, Ps) como se mostra na Figura 1.
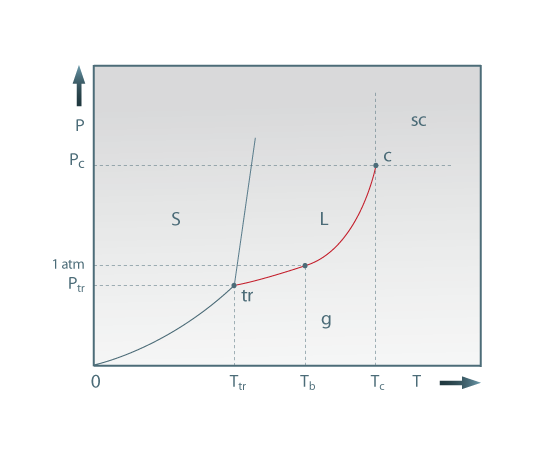
Figura 01: Diagrama (T, P ) de uma substância pura. As superfícies s, l e g representam, respectivamente, as regiões de estabilidade das fases sólida, líquida e gasosa. sc é a região do fluido supercrítico. O ponto triplo é tr; c é o ponto crítico; as coordenadas (T,P) de cada um deles estão também indicadas. As curvas representam as linhas de equilíbio das fases que as limitam. A curva assinalada a vermelho é e a curva de vaporização da substância.
O diagrama da figura 1 é interpretado da seguinte forma. Em primeiro lugar registam-se as superfícies monofásicas – do sólido (s), do líquido ( l) e do gás (g) - que definem os domínios de estabililidade de cada uma das fases. A fase sólida é estável às temperaturas mais baixas (inferiores a Ttr) e a pressões que se estendem até aos valores elevados de P; o domínio da fase gasosa vai desde pressões muito baixas (zero, no limite) até temperaturas que atingem os valores mais elevados; a fase líquida é estável a pressões e temperaturas intermédias relativamente às anteriores. Se a partir de um ponto de coordenadas (P, T) no interior de qualquer uma destas superfícies, fizermos variar a temperatura de uma quantidade elementar, dT, podemos fazer variar, simultaneamente, a pressão de uma quantidade arbitrária (dentro de certos limites) sem que se altere a natureza da fase de que partimos.Por este motivo no interior de cada uma destas regiões a variância ou grau de liberdade é igual a dois. Na mesma figura, as curvas representam as linhas de equilíbrio bifásico. A curva [0,Tr], que delimita as superfícies de estabilidade do sólido e do gás, corresponde ao equilíbrio (s+g), denominando-se curva de sublimação. A curva quase vertical, com curvatura pouco acentuada, correspondente ao equilíbrio (s+l), é a curva de fusão. A elevada inclinação desta linha, em todos os seus pontos (T, P), significa que para grandes acréscimos da pressão correpondem apenas pequenas variações na temperatura de fusão.O troço (a vervelho) entre os pontos Tr e c é a curva de vaporização (ou curva das pressões de vapor), e define o equilíbrio (l+g).
Ao longo da curva de vaporização ao fazer variar a temperatura de uma quantidade elementar, dT, para que continuemos a observar equilíbrio termodinâmico entre as (mesmas) duas fases de que partimos, a pressão fica obrigada a variar de um valor determinado pelo comportamento (T, P) da curva em questão; se a variação de pressão for diferente dessa deixará de se observar o equilíbrio bifásico inicial, alcançando-se, no final, um ponto algures numa das regiões monofásicas adjacentes. Isto corresponde a dizer que ao longo da curva de vaporização existe apenas um grau de liberdade. Há ainda que assinalar no diagrama dois pontos notáveis: tr e c. O ponto triplo, (tr), corresponde ao equilíbrio simultâneo de três fases (s+l+g). O ponto crítico (c) é o ponto extremo da curva de vaporização. Uma propriedade interessante observada no ponto crítico é que os volumes molares do líquido (Vml ) e do gás em equilíbrio (Vmg ), diferentes entre si para T<Tc, acabam por coincidir em c. Ora se, para T=Tc, os volumes molares coincidem, o mesmo se passará com as respectivas densidades. Então, fisicamente, à temperatura crítica, o menisco de separação das duas fases desaparece e as duas fases tornam-se indistinguíveis. Acima da temperatura crítica e/ou da pressão crítica não pode observar-se equilíbrio estável entre o líquido e o seu vapor. Convém sublinhar que o diagrama (P,T) evidencia que a temperaturas ou pressões superiores a Tc ou Pc, respectivamente, não é possível observar equilíbrio (l+g). A região do diagrama correspondente a P> Pc e T > Tc é designada por região supercrítica e as substâncias nessas condições chamam-se fluidos supercríticos.
Determinacão de equilíbrio líquido-vapor (ELV) de substâncias puras pelas fugacidades
Para uma substância pura, nas condições de saturação (ou de equilíbrio), o equilíbrio entre a fase líquida (l) e a fase de vapor (g) à temperatura T e à pressão de equilíbrio Pσ* (pressão de vapor ou pressão de saturação) é traduzida sob o ponto de vista termodinâmico pela igualdade das fugacidades:
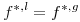
| (1) |
onde fi designa a fugacidade do componente puro i. Para uma substância pura é f=φ P onde φ é o coeficiente de fugacidade e P a pressão. Como as fases líquida e gasosa estão necessariamente à mesma pressão, Pσ*, conclui-se que:
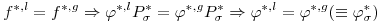
| (2) |
onde js representa o coeficiente de fugacidade da substância pura (líquida ou gasosa), nas condições de equilíbrio (T, Pσ*). Quer dizer a condição de equilíbrio termodinâmico da igualdade das fugacidades é equivalente à igualdade dos coeficientes de fugacidade. O coeficiente de fugacidade pode ser determinado a partir de uma equação de estado. A função φ* depende da temperatura, da pressão e do volume molar, Vm. Por exemplo para a equação de Redlich-Kwong,
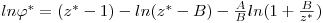
| (3) |
com
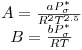 | (4) |
sendo a e b parâmetros da equação de Redlich e Kwong. Na equação (3), z é o factor de compressibilidade definido pela relação z = (Pσ* Vm)/(RT).
A equação (2) pode ser escrita de uma forma mais conveniente para o cálculo da pressão de vapor como
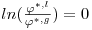 | (5) |
O valor da pressão de vapor Pσ* resultará da resolução da equação (4) à temperatura de equilíbrio T genérica. Sobre a resolução deste tipo de problema veja-se por exemplo [1].
Referências
- Lobo, L. Q.; Ferreira A. G. M. “ Termodinâmica e Propriedades Termofísicas, Volume 1, Termodinâmica das fases” ; Imprensa da Universidade de Coimbra, Coimbra 2006 (ISBN972-8704-91-7)