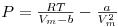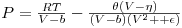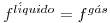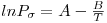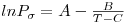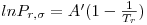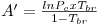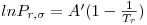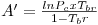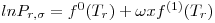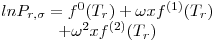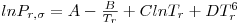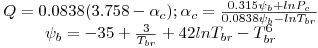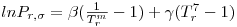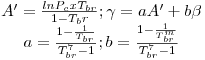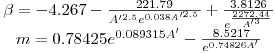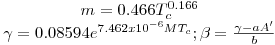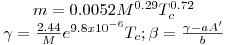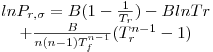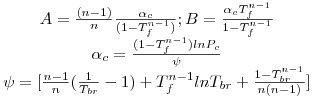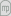Regra de Maxwell
Representação e Estimativa da pressão de vapor de substâncias puras
Referências
Regra de Maxwell
Objectivo
Determinação de valores pressão, volume e temperatura (PVT) de substâncias puras utilizando equações de estado cúbicas no volume molar da família de van der Waals. Cálculo da pressão de vapor e dos volumes molares das fases líquida e gasosa em equilíbrio utilizando a regra de Maxwell.
Teoria
Em 1873, van der Waals (VDW) propôs para a representação do comportamento PVT das substâncias a equação [1]
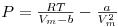 | (1) |
Esta equação surge como a primeira equação de estado (EDE) suficientemente realista capaz de interpretar (qualitativamente) o comportamento PVT das substâncias puras e das misturas. A equação de van der Waals conseguiu interpretar por exemplo o andamento das isotérmicas das substâncias puras já conhecido dos trabalhos de Andrews (realizados entre 1861 e 1869) . Na equação (1) a e b são os parâmetros atractivo e repulsivo (de van der waals), respectivamente e Vm designa o volume molar. Os parâmetros a e b estão relacionados com a intensidade das forças intermoleculares atractivas e repulsivas. O parâmetro b é também designado por co-volume e representa o volume excluido por mole (número de Avogadro de partículas). A equação (1) pode ser vista como a soma de uma pressão repulsiva, determinada pelo balanço das forças repulsivas com uma pressão atractiva, determinada pelo jogo das forças atractivas, quer dizer P = P(atractiva) + P(repulsiva).
A partir de 1949 têm surgido inúmeras equações que no seu fundamento retêm as ideias de van der Waals.
As equações da família de VDW podem ser expressas pela seguinte equação geral,
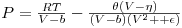
| (2) |
e algumas das equações são dadas na tabela 1 a seguir. Muitas outras podem ser encontradas em [ 2] e [ 3].
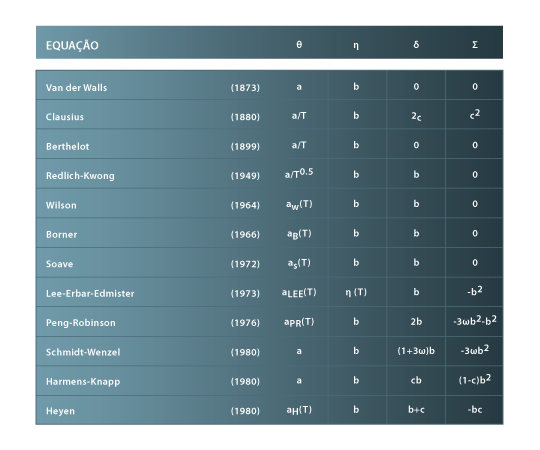
Tabela 01: Parâmetros da Eq. (2) para algumas eqs. da família de VDW.
A equação (2) é do terceiro grau no volume molar. Na Figura 1 está representada uma isotérmica subcrítica para a equação de Redlich-Kwong de uma substância pura genérica. Observam-se as assimptotas verticais (Vm = -b ,0 , b) e verifica-se que apenas o troço I da isotérmica tem significado físico (valores de Vm>b). Neste troço para a pressão de vapor ou de saturação (Pσ*=psat) existem três raízes para o volume molar que são VA, VC e VE. VA representa o volume molar da fase líquida em equilíbrio com o gás de volume molar VE. A raiz VC não tem significado físico uma vez que fica situada na curva onde o volume molar aumenta com a pressão o que é contrário ao que se observa experimentalmente.
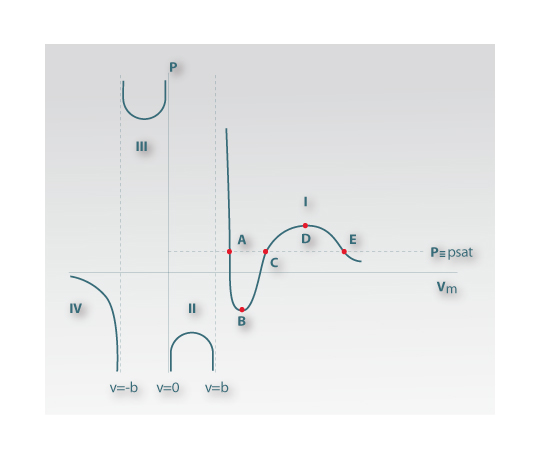
Figura 01: Esquema de uma isotérmica subcrítica para a EDE de Redich-Kwong [4].
O cálculo das propriedades (PVT) do equilíbrio líquido+gás (isto é a determinação da pressão de vapor e dos volumes molares das fases líquida e da fase gasosa em equilíbrio) pode ser efectuado com a regra de Maxwell ilustrada na Figura 1. Segundo esta regra para uma dada equação de estado os valores de equilíbrio das propriedades referidas anteriormente são aqueles que tornam iguais as áreas [ABCA] e [CDEC]. Para a demonstração ver a referência [4], pg 347. O cálculo das propriedades de equilíbrio (Vml , Vmg e Psat = Pσ*), podem ser determinadas através do seguinte esquema de cálculo:
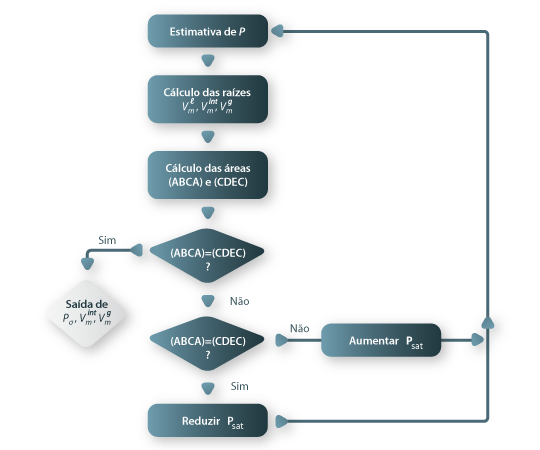
Figura 02: Esquema de cálculo de (Vml , Vmg e Pσ*=xPsat ) pela regra de Maxwell.
Pode mostrar-se ainda que a regra de Maxwell é equivalente ao critério termodinâmico da igualdade de fugacidades,
onde f designa a fugacidade.
::: Início :::
Representação e Estimativa da pressão de vapor de substâncias puras
Teoria
A pressão de vapor ao longo da curva de vaporização é função da temperatura. Existe um número elevado de equações para o cálculo da pressão de vapor. Por exemplo, a equação de Wrede, uma das mais simples, escreve-se como
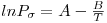
| (3) |
Na perspectiva da equação anterior (de parâmetros A e B) a representação do logaritmo da pressão de vapor (ln Pσ) em função do inverso da temperatura (1/T) é uma recta. Sabe-se que esta representação é aproximada e é válida numa região estreita de temperaturas (próxima do ponto triplo ou, quando muito, até ao ponto de ebulição normal). A equação de Antoine com três parâmetros ajustáveis estatisticamente consegue uma representação em regiões mais alargadas de temperaturas que a eq. (3). A forma analítica da equação de Antoine é
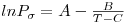 | (4) |
onde A, B e C são parâmetros ajustáveis a valores experimentais da pressão de vapor. Estes parâmetros estão disponíveis na literatura para um elevado número de compostos [5]. A equação de Antoine geralmente aplica-se com bons resultados entre 0.2 e 2 atm e extrapola com resultados razoáveis até T = 0.75 Tc. A equação de Antoine tem a particularidade de permitir a inversão imediata de Pσ(T) para T(Pσ) ao contrário do que acontece com a maioria das equações da pressão de vapor para as quais é necessário aplicar metodos iterativos.
Quando aplicadas à previsão da pressão de vapor, as equações são escritas geralmente na forma reduzida como ln Pr= F(Tr, parâmetros). Por exemplo a eq. (3) quando é aplicada ao ponto de ebulição normal (onde Pσ=1 atm e T=Tb) e ao ponto crítico, de coordenadas (T=Tc, Pσ=Pc), origina,
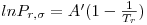 | (5) |
onde
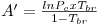
| (6) |
sendo Tbr a temperatura reduzida no ponto de ebulição normal (Tbr=Tb/Tc). Tal como a eq. (5) mostra, a equação de Wrede na forma reduzida tem dois parâmetros (Tbr e Pc). Na Tabela 2 faz-se um resumo das equações da pressão de vapor mais utilizadas, escritas na forma reduzida assinalando-se os métodos de cálculo dos parâmetros que nelas figuram.
| Equação | Parâmetros
|
Wrede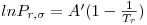
| 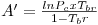 |
Pitzer 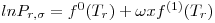
| f0=5.92714-6.0948Tr-1-1.28862lnTr+0.169347Tr6
f1=15.2518-15.6875Tr-1-13.4721lnTr+0.43577Tr6
|
Ambrose-Walton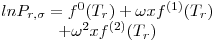
| f(0)=Tr-1(-5.97616τ+1.29874τ1.5-0.60394τ2.5-1.06841τ5)
f(1)=Tr-1(-5.03365τ+1.11505τ1.5-5.41217τ2.5-7.46628τ5)
f(2)=Tr-1(-0.64771τ+2.41539τ1.5-4.26979τ2.5+3.25259τ5) |
Riedel
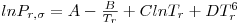 | A=-35Q; B=-36Q;C=42Q+αc; D=-Q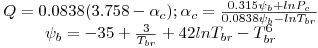
|
Gomez-Nieto-Thodos
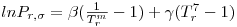 | 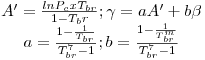
para compostos não polares:
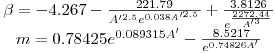
para compostos polares sem pontes de hidrogénio:
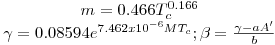
para compostos com ligações de hidrogénio: 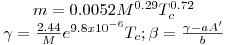 |
Vetere
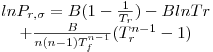 | 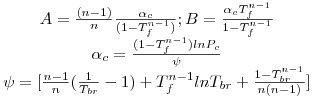
parâmetros n e Tf
| Composto | n | Tf | Hidrocarbonetos (lineares, cíclicos e halogenados)
| 6
| =0.0676+0.8929Trb+0.05165lnPc
| Alcoóis
| 4
| =0.9475-0.0015lnPc | Ácidos Orgânicos
| 6
| =0.6640+0.00045Trb
| Outros compostos polares
| 6
| =0.0648+0.9569Trb+0.0415lnPc
|
|
Na Figura 3 mostra-se o resultado da aplicação de várias equações da Tabela 2 ao benzeno.
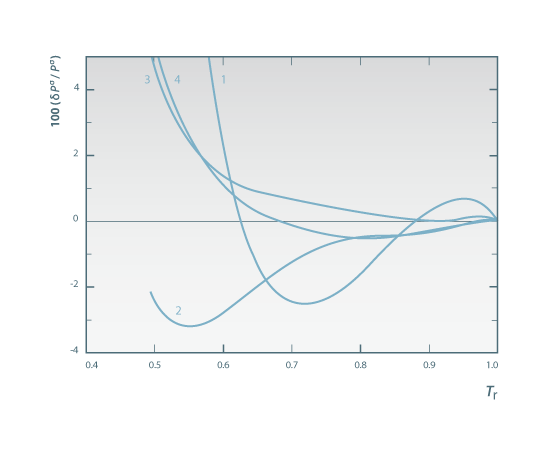
Figura 03: Comparação entre os valores tabelados da pressão de vaporização do benzeno com os calculados a partir de vários métodos pelo princípio dos estados correspondentes. Em abcissas representa-se a temperatura reduzida e em ordenadas o desvio relativo percentual. Legenda: 1 – eq. de Wrede; 2- eq. de Pitzer; 3- eq. de Gomez-Nieto-Thodos; 4- eq. de Frost- Kalkwarf-Thodos.
::: Início :::
Referências
- van der Waals, J . D. "Over de continuïteit van de gas-en vloeistoftoestand" ("Acerca da continuidade dos estados gasoso e líquido "),Doctoral Dissertation, Leiden, 1873.
- Poling, B. E., Prausnitz, J. M., O' Connell J. P., " The Properties of Gases and Liquids", 5th ed., McGraw-Hill, New York. 2000.
- Martin, J. J. Ind. Eng. Chem. Fundam., 18 (1979) 81.
- Lobo, L. Q., Ferreira, A. G. M., "Termodinâmica e Propriedades Termofísicas Vol. I, Termodinâmica das Fases", IUC, Coimbra, 2006.
- Reid, R. C., Prausnitz, J. M., Sherwood, T. K. " The Properties of Gases and Liquids", 3rd ed., McGraw-Hill, New York. 1984.
- (Pitzer) B. I. Lee, M. G. Kesler, AIChE J. 21 (1975) 510
- (Ambrose e Walton) D. Ambrose, J. Walton, Pure Appl. Chem. 61 (1989) 1395.
- (Riedel) L. Riedel, Chem. Ing. Tech. 26 (1954) 83.
- (Frost-Kalkwarf-Thodos) A. A. Frost, D. R. Kalkwarf, J. Chem. Phys. 21 (1953) 264, D. L. Bond, G. Thodos, J. Chem. Eng. Data 5 (1960) 289.
- (Riedel-Plank-Miller) D. G. Miller, J. Phys. Chem. 69 (1965) 3209.
- (Gomez-Nieto-Thodos) M. Gomez-Nieto, G. Thodos, Can. J. Chem. Eng. 55 (1977) 445.
- (Vetere) A. Vetere, Fluid Phase Equil. 43 (1988) 191.
::: Início :::