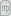Fundamentos do equilíbrio líquido-líquido (LLE)
A temperaturas suficientemente inferiores aquelas em que se verifica o aparecimento do equillíbrio líquido-vapor, pode observar-se a formação de fases líquidas (ou sólidas) total ou parcialmente imiscíveis. É o que acontece, por exemplo, no sistema cujo diagrama se esquematiza na Figura 1.
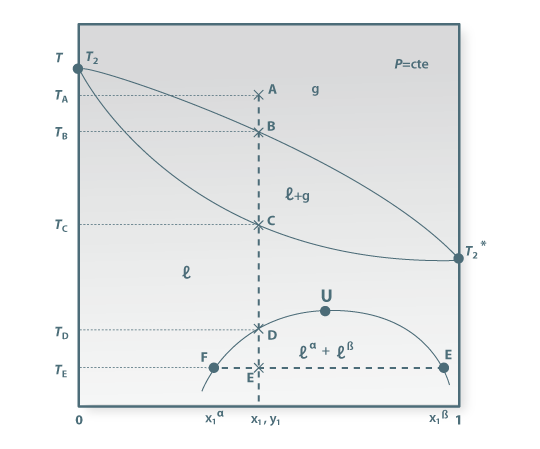
Figura 01: Esquema ilustrativo do diagrama de fases de um sistema com formação de duas fases líquidas, ?α e ?β, a temperaturas inferiores. T1* e T2* são as temperaturas de vaporização dos componentes 1 e 2 respectivamente, à pressão P.
Observando na Figura 1 verifica-se que partindo de uma mistura binária homogénea, gasosa, no estado representado pelo ponto A, baixando sucessivamente a temperatura (mantendo a pressão), quando se atinge a temperatura TB aparece a primeira gota de líquido (o ponto B está sobre a curva dos pontos de orvalho). Entre B e C, à medida que a temperatura diminui, a quantidade de sistema na fase líquida vai aumentando até que, à temperatura TC, desaparece a último gás (o ponto C localiza-se sobre a curva dos pontos de bolha). Entre TC e TD obtém-se uma única fase líquida, homogénea. À temperatura TD observa-se a formação de uma segunda fase líquida. Se a fase líquida pré-existente estiver a ser agitada, o aparecimento da imiscibilidade (parcial) entre os dois líquidos pode ser facilmente detectado pela ocorrência de turbidez no sistema líquido. Abaixo da temperatura TD têm-se duas fases líquidas, ?α e ?β, parcialmente miscíveis, em equilíbrio. Por exemplo á temperatura TE a mistura de composição global representada pelo ponto E separa-se em duas fases líquidas representadas pelos pontos F e G. A recta horizontal 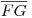 é, obviamente, uma tie-line, visto que une duas fases em equilíbrio à mesma temperatura e à mesma pressão. Considerando apenas a região inferior do diagrama, correspondente às temperaturas em que prevalece a coexistência de fases líquidas, podem observar-se três situações, que se ilustram na Figura 2.
é, obviamente, uma tie-line, visto que une duas fases em equilíbrio à mesma temperatura e à mesma pressão. Considerando apenas a região inferior do diagrama, correspondente às temperaturas em que prevalece a coexistência de fases líquidas, podem observar-se três situações, que se ilustram na Figura 2.
![Diagramas (T, x), a pressão constante, ilustrando esquematicamente três tipos possíveis de imiscibilidade (parcial), líquido α + líquido β: (a) com temperatura crítica de solubilidade superior (ponto U); (b) com ponto crítico de solubilidade inferior (ponto L); (c) com existência simultânea de U e L. Retirado de [1].](images/stories/llefund2.png)
Figura 02: Diagramas (T, x), a pressão constante, ilustrando esquematicamente três tipos possíveis de imiscibilidade (parcial), líquido α + líquido β: (a) com temperatura crítica de solubilidade superior (ponto U); (b) com ponto crítico de solubilidade inferior (ponto L); (c) com existência simultânea de U e L. Retirado de [1].
A situação de imiscibilidade parcial que acaba de ser descrita está representada na Figura 2(a). As composições dos dois líquidos em equilíbrio (?a e ?b) à temperatura TE são, respectivamente, x1α e x1β. A temperatura TU é denominada temperatura crítica de solubilidade superior: acima dessa temperatura existe uma única fase líquida em toda a gama de composições (0 ≤ x1 ≤ 1). A linha  é denominada curva binodal. O troço
é denominada curva binodal. O troço 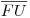 , à esquerda de U, corresponde às composições da fase líquida ?a (mais rica no componente 2) ao passo que o troço
, à esquerda de U, corresponde às composições da fase líquida ?a (mais rica no componente 2) ao passo que o troço 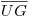 , à direita de U, dá as composições da fase líquida ?b (mais rica no componente 1): a cada temperatura T (<TU) as composições x1α e x1β dos dois líquidos em equilíbrio são determinadas pela intersecção da curva binodal com a tie-line (horizontal) respectiva. É claro que a temperaturas sucessivamente mais baixas as fases líquidas acabarão por solidificar e a curva binodal terminará na linha de solidificação. No ponto U as duas fases líquidas tornam-se indistinguíveis. A designação de ponto crítico de solubilidade para U (e de temperatura crítica de solubilidade para TU), resulta disto mesmo por analogia com o ponto crítico das substâncias puras, onde duas fases (líquida e gasosa) também se tornam idênticas, com as mesmas propriedades. A Figura 2(b) ilustra um outro caso possível de imiscibilidade parcial de duas fases líquidas, onde agora o ponto L corresponde a uma temperatura crítica de solubilidade inferior. Abaixo da temperatura TL existe uma só fase líquida em toda a gama de composições. A curva binodal é limitada superiormente pelas suas intersecções com a curva dos pontos de bolha no equilíbrio (líquido + vapor). O caso representado na Figura 2(c), em que a curva binodal se fecha sobre si própria, com existência simultânea de dois pontos críticos, superior e inferior (U e L, respectivamente), é bastante mais raro: neste caso a imiscibilidade parcial das duas fases líquidas só pode ocorrer a temperaturas entre TU e TL.
, à direita de U, dá as composições da fase líquida ?b (mais rica no componente 1): a cada temperatura T (<TU) as composições x1α e x1β dos dois líquidos em equilíbrio são determinadas pela intersecção da curva binodal com a tie-line (horizontal) respectiva. É claro que a temperaturas sucessivamente mais baixas as fases líquidas acabarão por solidificar e a curva binodal terminará na linha de solidificação. No ponto U as duas fases líquidas tornam-se indistinguíveis. A designação de ponto crítico de solubilidade para U (e de temperatura crítica de solubilidade para TU), resulta disto mesmo por analogia com o ponto crítico das substâncias puras, onde duas fases (líquida e gasosa) também se tornam idênticas, com as mesmas propriedades. A Figura 2(b) ilustra um outro caso possível de imiscibilidade parcial de duas fases líquidas, onde agora o ponto L corresponde a uma temperatura crítica de solubilidade inferior. Abaixo da temperatura TL existe uma só fase líquida em toda a gama de composições. A curva binodal é limitada superiormente pelas suas intersecções com a curva dos pontos de bolha no equilíbrio (líquido + vapor). O caso representado na Figura 2(c), em que a curva binodal se fecha sobre si própria, com existência simultânea de dois pontos críticos, superior e inferior (U e L, respectivamente), é bastante mais raro: neste caso a imiscibilidade parcial das duas fases líquidas só pode ocorrer a temperaturas entre TU e TL.
Diagramas ternários
Para representar sistemas ternários recorre-se à geometria dos prismas de base triangular onde às ordenadas se faz corresponder a temperatura ou a pressão e à base (um triângulo equilátero) se associa a composição dos componentes em fracção molar (ou percentagens molares) (x1, x2 e x3) ou fracções (ou percentagens ponderais) (w1, w2 e w3). Como a soma das distâncias de um ponto no interior de um triângulo (equilátero) aos três lados é igual à sua altura, h, (ver Figura 3), será h=a+b+c. Normalizando, ter-se-á que a/h= x1 (ou w1), b/h=x2 (ou w2) e c/h=x3 (ou w3) e desta forma verifica-se a relação entre as fracções molares 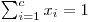 (ou, entre fracções mássicas,
(ou, entre fracções mássicas, 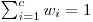 ).
).
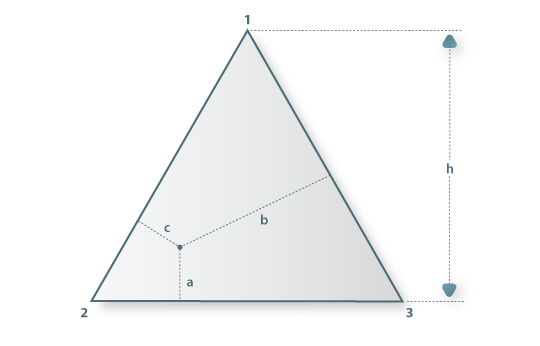
Figura 03: Triângulo equilátero utilizado na representação das variáveis de composição em sistemas ternários. A altura h é h=a+b+c, pelo que x1(ou w1)=a/h, x2(ou w2)=b/h e x3(ou w3)=c/h.
Aos vértices do triângulo fazem-se corresponder os componentes puros da mistura ternária. Qualquer ponto sobre um dos lados do triângulo representa, assim, (a composição de) uma mistura binária, enquanto os pontos no interior do triângulo representam misturas dos três componentes, como se ilustra na Figura 4. Misturando dois sistemas ternários cujas composições sejam dadas pelos pontos P e Q obtém-se, sempre, um sistema cuja composição global é dada por um ponto sobre a recta  . A localização exacta do ponto representativo do sistema final R dependerá das massas relativas de P e Q que se misturarem. Se a uma mistura binária dos componentes 2 e 3 representada pelo ponto E, formos adicionando quantidades crescentes do componente 1 obtemos um sistema ternário cuja composição é representada por sucessivos pontos sobre a recta [1SE], uma vez que as proporções dos componentes 2 e 3 no sistema se mantêm. Quanto maior for a quantidade de componente 1 adicionada mais o ponto (S) que representa o sistema ternário se afastará da base, i.e. do ponto E, sobre o lado [23], e se aproximará do vértice 1, correspondente à substância que está a ser adicionada. Se, pelo contrário, partimos de um sistema ternário de composição dada por S e se dele formos removendo o componente 1 (por exemplo, por evaporação), a composição global do sistema vai evoluindo de modo que a sua representação se desloca sobre a recta [1SE] aproximando-se do ponto E.
. A localização exacta do ponto representativo do sistema final R dependerá das massas relativas de P e Q que se misturarem. Se a uma mistura binária dos componentes 2 e 3 representada pelo ponto E, formos adicionando quantidades crescentes do componente 1 obtemos um sistema ternário cuja composição é representada por sucessivos pontos sobre a recta [1SE], uma vez que as proporções dos componentes 2 e 3 no sistema se mantêm. Quanto maior for a quantidade de componente 1 adicionada mais o ponto (S) que representa o sistema ternário se afastará da base, i.e. do ponto E, sobre o lado [23], e se aproximará do vértice 1, correspondente à substância que está a ser adicionada. Se, pelo contrário, partimos de um sistema ternário de composição dada por S e se dele formos removendo o componente 1 (por exemplo, por evaporação), a composição global do sistema vai evoluindo de modo que a sua representação se desloca sobre a recta [1SE] aproximando-se do ponto E.
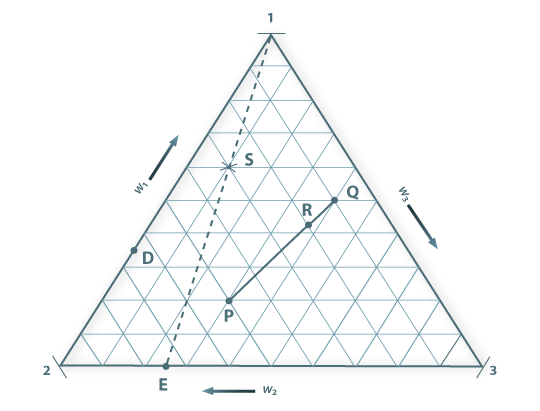
Figura 04: Representação da composição de um sistema ternário. Os wi são as fracções ponderais dos componentes. Os vértices 1, 2 e 3 representam os componentes puros; D representa uma mistura binária dos componentes 1 e 2; E é uma mistura binária de 2 e 3; os pontos P, Q, R e S representam misturas dos três componentes (1, 2 e 3).
Vamos agora ver como se interpretam geometricamente os diagramas de fases ternários onde os três componentes (1, 2 e 3) do sistema são líquidos à temperatura e à pressão consideradas.
Se dois dos componentes forem parcialmente miscíveis, o diagrama representativo das diversas composições apresentará o aspecto ilustrado na Figura 5. É um diagrama do tipo I.
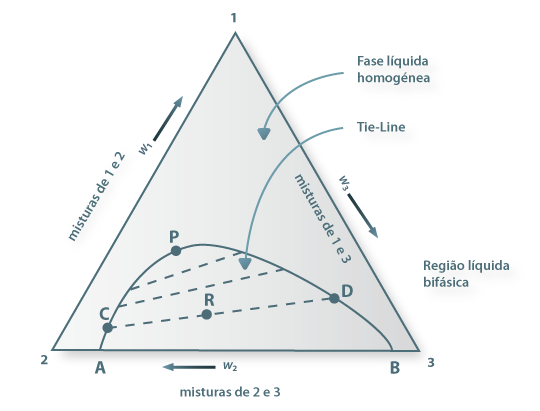
Figura 05: Esquema para ilustração de um diagrama ternário (1,2,3) em que os componentes 2 e 3 são parcialmente miscíveis (à temperatura e à pressão consideradas). P é o ponto de enlace. A recta CD é uma tie-line.
À temperatura e pressão consideradas, no interior da área limitada pelos pontos [ACPDB] existem duas fases (líquidas) imiscíveis: o ponto A representa o limite de solubilidade do componente 3 no componente 2; em contrapartida, o ponto B representa o limite de solubilidade do componente 2 no componente 3; quando o sistema contém, também, o componente 1 e a composição global é representada por um ponto no interior da área [ACPDB] o sistema desdobra-se em duas fases líquidas ternárias em equilíbrio termodinâmico. Por exemplo, um sistema ternário de composição global dada pelo ponto R apresenta-se como sendo constituído por duas fases líquidas cujas composições são dadas pelos pontos C e D. A linha recta [CRD] une duas fases em equilíbrio: uma (a fase com a composição do ponto D) mais rica no componente 3 e outra (a fase com a composição dada pelo ponto C) mais rica no componente 2. Quer dizer: a adição do componente 1 aos sistemas binários de componentes 2 e 3 cuja composição inicial esteja compreendida entre as de A e B dá origem ao aumento da solubilidade mútua de 2 e 3, de modo que a zona bifásica vai diminuindo, até se atingir um ponto também ternário de composição dada por P, em que a solubilidade de 2 em 3 e a de 3 em 2 se igualam. O ponto P designa-se por ponto de enlace ou ponto crítico (ou plait point, em Inglês). As rectas como [CD] que unem duas fases em equilíbrio são denominadas tie-lines, na designação em língua inglesa, que se generalizou. Pelo que ficou dito se conclui que a linha [ACP] é a curva de solubilidade do componente 3 no sistema constituído pelos três líquidos 1, 2 e 3, enquanto que a curva [PDB] representa os limites de solubiliddae do componente 2 no sistema ternário. A curva de solubilidade limitante da zona bifásica [ACPDB] denomina-se curva binodal. No exterior da curva binodal um sistema ternário como o que estamos a tratar é monofásico.
À medida que aumenta a temperatura a solubilidade mútua dos componentes aumenta (geralmente) devido à agitação molecular, pelo que a área bifásica nos diagramas triangulares como o da Figura 5 vai sendo cada vez mais reduzida, como se torna evidente observando a Figura 6. Em projecção sobre a base do prisma triangular obtêm-se as curvas de solubilidade às diversas temperaturas como se esquematiza na Figura 6(b).
![Diagrama ternário (T, wi) esquemático, a pressão constante. Até temperaturas pouco superiores a T3 os componentes 2 e 3 são parcialmente imiscíveis. A temperaturas superiores à do ponto P o sistema é homogéneo (monofásico). Retirado de [1].](images/stories/llefund6.png)
Figura 06: Diagrama ternário (T, wi) esquemático, a pressão constante. Até temperaturas pouco superiores a T3 os componentes 2 e 3 são parcialmente imiscíveis. A temperaturas superiores à do ponto P o sistema é homogéneo (monofásico). Retirado de [1].
Por vezes acontece que dentre os três líquidos há dois pares (e não um só) que são parcialmente imiscíveis. São os diagramas do tipo II. Nesta situação o diagrama triangular tem o aspecto que se mostra na Figura 7. Se a temperatura baixar as duas zonas bifásicas aumentam de área, de forma que poderão intersectar-se, coalescendo, como se mostra na Figura 8. Neste caso o diagrama (T, wi), ou (T, xi), teria o aspecto ilustrado na Figura 9.
![Diagrama triangular em que os pares 1-3 e 1-2 são parcialmente imiscíveis. As rectas no interior das zonas bifásicas representam tie-lines. Retirado de [1].](images/stories/llefund7.png)
Figura 07: Diagrama triangular em que os pares 1-3 e 1-2 são parcialmente imiscíveis. As rectas no interior das zonas bifásicas representam tie-lines. Retirado de [1].
![Os pares 1-3 e 1-2 são parcialmente imiscíveis e as áreas de imiscibilidade mútua intersectam-se. As rectas no interior da zona bifásica são tie-lines. Retirado de [1].](images/stories/llefund8.png)
Figura 08: Os pares 1-3 e 1-2 são parcialmente imiscíveis e as áreas de imiscibilidade mútua intersectam-se. As rectas no interior da zona bifásica são tie-lines. Retirado de [1].
![Diagrama ternário (T, wi), esquemático, em que os pares (de líquidos) 1-2 e 1-3 são parcialmente imiscíveis até temperaturas ligeiramente abaixo de T´. Acima da temperatura T´e até T´´ a situação de imiscibilidade parcial só se observa para o par 1-2. Retirado de [1].](images/stories/llefund9.png)
Figura 09: Diagrama ternário (T, wi), esquemático, em que os pares (de líquidos) 1-2 e 1-3 são parcialmente imiscíveis até temperaturas ligeiramente abaixo de T´. Acima da temperatura T´e até T´´ a situação de imiscibilidade parcial só se observa para o par 1-2. Retirado de [1].
Quando os três líquidos forem parcialmente imiscíveis dois a dois e se as suas áreas de imiscibilidade parcial se intersectarem o diagrama triangular respectivo toma o aspecto que se mostra na Figura 10. São geralmente designados por diagramas do tipo III.
![Diagrama triangular em que os componentes 1, 2 e 3 são parcialmente imiscíveis à temperatura considerada. As regiões A são monofásicas, as áreas B são bifásicas e o interior do triângulo C corresponde à coexistência de três fases (cujas composições são dadas pelos pontos a, b e c). Retirado de [1].](images/stories/llefund10.png)
Figura 10: Diagrama triangular em que os componentes 1, 2 e 3 são parcialmente imiscíveis à temperatura considerada. As regiões A são monofásicas, as áreas B são bifásicas e o interior do triângulo C corresponde à coexistência de três fases (cujas composições são dadas pelos pontos a, b e c). Retirado de [1].
Para ilustrar alguns casos práticos, na Figura 11 mostra-se um conjunto de diagramas de equilíbrio líquído-líquido ara sistemas aquosos de etanol e esteres. Na figura podemos verificar a existência de diagramas de tipo I e tipo II.
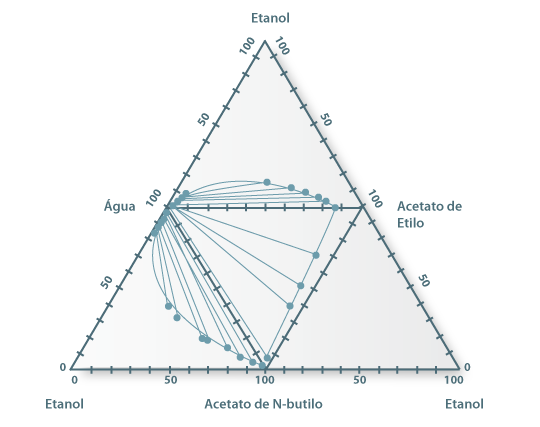
Figura 11: Diagramas ternários para o sistemas do tipo água+ester+etanol e água+acetato de N-butilo+acetato de etilo a 25 ºC.
Os diagramas ternários envolvendo fases líquidas são úteis para a compreensão da operação de extracção. Neste contexto usam-se as chamadas curvas de distribuição. Estas são construídas a partir dos diagramas triangulares, representando a concentração do componente que é solúvel nas duas fases parcialmente miscíveis, uma em função da outra. Podem surgir aqui várias situações indicadas na Figura 12. Por exemplo, se os componentes 1 e 2 forem parcialmente imiscíveis e o componente 3 for completamente miscível quer com o componente 1 quer com o componente 2, designando por w3,1 a concentração (em fracção ponderal) do componente 3 na fase mais rica no componente 1 e por w3,2 a concentração do componente 3 na fase mais rica no componente 2 obtém-se do diagrama triangular a curva de distribuição respectiva como se ilustra na Figura 12(a). Nesta figura apresenta-se, de forma genérica, o processo de construção.
![Diversos tipos de curvas de distribuição. O exemplo (c) é de um sistema solutrópico: a inclinação das tie-lines diverge, passando de positiva a negativa. No diagrama (b) não há ponto de enlace. Retirado de [1].](images/stories/llefund12.png)
Figura 12: Diversos tipos de curvas de distribuição. O exemplo (c) é de um sistema solutrópico: a inclinação das tie-lines diverge, passando de positiva a negativa. No diagrama (b) não há ponto de enlace. Retirado de [1].
Estes conceitos são muito importantes na extracção líquido-líquido tão importantes que a nomenclatura desta operação unitária adoptou designações particulares para os componentes e para as fases em equilíbrio. Para assentar conceitos considere-se a Figura 13 onde se representa um diagrama ternário em que à temperatura considerada os componentes 1 e 2 são completamente miscíveis (como, aliás também acontece com o par 1-3).
![Diagrama ternário a temperatura constante. As linhas a tracejado são tie-lines. Retirado de [1].](images/stories/llefund13.png)
Figura 13: Diagrama ternário a temperatura constante. As linhas a tracejado são tie-lines. Retirado de [1].
Admitamos que pretendiamos separar as substâncias líquidas 1 e 2 existentes numa mistura (binária) inicial representada pelo ponto F. Adicionando quantidades crescentes de componente 3 (que se designa por solvente) à mistura F a composição global do sistema mover-se-á ao longo da recta [FM3]. Por adição de quantidade adequada do componente 3, a composição global do sistema (ternário) passa a ser representada pelo ponto M. Neste ponto o sistema é heterogéneo, separando-se em duas fases cujas composições são dadas pelos pontos P e Q.
A fase Q tem uma composição mais rica no solvente (componente 3). Esta fase, em terminologia de extracção líquido-líquido, é denominada fase extracto (ou fase solvente). A fase P, que tem um mais baixo conteúdo em solvente, chama-se fase refinado (ou fase resíduo). Eliminando progressivamente o solvente (componente 3) da fase extracto (Q), por destilação ou outra operação equivalente, obtém-se um extracto livre de solvente cuja composição é representada pelo ponto S na Figura 10. Da mesma forma, o refinado (ou resíduo), R, é obtido da fase P por eliminação do solvente. Assim, por extracção líquido-líquido (que começa pela adição de solvente à mistura binária inicial, F) e separação das duas fases resultantes (P e Q) seguida de remoção do solvente (componente 3) de cada uma das fases em equilíbrio, a mistura original (F) pode ser separada em duas outras misturas binárias (R e S). Comparando com a mistura inicial (F) a mistura S tem uma composição mais elevada no componente 1 e a mistura R contém uma menor fracção deste componente. Este princípio de separação pode ser repetido sequencialmente com vista à separação dos componentes 1 e 2 (completamente miscíveis) em extractos e refinados progressivamente mais ricos nos componentes (1 ou 2) que se querem separar por extracção líquido-líquido. É claro que a extensão do processo de extracção está condicionada pela temperatura e pressão, pela área coberta pela curva de solubilidade e pela natureza do sistema ternário.
Bibliografia
- Lobo, L. Q.; Ferreira, A. G. M. Termodinâmica e Propriedades Termofísicas, Volume I, Termodinâmica das Fases; Imprensa da Universidade de Coimbra: Coimbra, 2006.






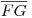 é, obviamente, uma tie-line, visto que une duas fases em equilíbrio à mesma temperatura e à mesma pressão. Considerando apenas a região inferior do diagrama, correspondente às temperaturas em que prevalece a coexistência de fases líquidas, podem observar-se três situações, que se ilustram na Figura 2.
é, obviamente, uma tie-line, visto que une duas fases em equilíbrio à mesma temperatura e à mesma pressão. Considerando apenas a região inferior do diagrama, correspondente às temperaturas em que prevalece a coexistência de fases líquidas, podem observar-se três situações, que se ilustram na Figura 2.![Diagramas (T, x), a pressão constante, ilustrando esquematicamente três tipos possíveis de imiscibilidade (parcial), líquido α + líquido β: (a) com temperatura crítica de solubilidade superior (ponto U); (b) com ponto crítico de solubilidade inferior (ponto L); (c) com existência simultânea de U e L. Retirado de [1].](images/stories/llefund2.png)
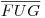 é denominada curva binodal. O troço
é denominada curva binodal. O troço 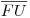 , à esquerda de U, corresponde às composições da fase líquida ?a (mais rica no componente 2) ao passo que o troço
, à esquerda de U, corresponde às composições da fase líquida ?a (mais rica no componente 2) ao passo que o troço 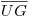 , à direita de U, dá as composições da fase líquida ?b (mais rica no componente 1): a cada temperatura T (<TU) as composições x1α e x1β dos dois líquidos em equilíbrio são determinadas pela intersecção da curva binodal com a tie-line (horizontal) respectiva. É claro que a temperaturas sucessivamente mais baixas as fases líquidas acabarão por solidificar e a curva binodal terminará na linha de solidificação. No ponto U as duas fases líquidas tornam-se indistinguíveis. A designação de ponto crítico de solubilidade para U (e de temperatura crítica de solubilidade para TU), resulta disto mesmo por analogia com o ponto crítico das substâncias puras, onde duas fases (líquida e gasosa) também se tornam idênticas, com as mesmas propriedades. A Figura 2(b) ilustra um outro caso possível de imiscibilidade parcial de duas fases líquidas, onde agora o ponto L corresponde a uma temperatura crítica de solubilidade inferior. Abaixo da temperatura TL existe uma só fase líquida em toda a gama de composições. A curva binodal é limitada superiormente pelas suas intersecções com a curva dos pontos de bolha no equilíbrio (líquido + vapor). O caso representado na Figura 2(c), em que a curva binodal se fecha sobre si própria, com existência simultânea de dois pontos críticos, superior e inferior (U e L, respectivamente), é bastante mais raro: neste caso a imiscibilidade parcial das duas fases líquidas só pode ocorrer a temperaturas entre TU e TL.
, à direita de U, dá as composições da fase líquida ?b (mais rica no componente 1): a cada temperatura T (<TU) as composições x1α e x1β dos dois líquidos em equilíbrio são determinadas pela intersecção da curva binodal com a tie-line (horizontal) respectiva. É claro que a temperaturas sucessivamente mais baixas as fases líquidas acabarão por solidificar e a curva binodal terminará na linha de solidificação. No ponto U as duas fases líquidas tornam-se indistinguíveis. A designação de ponto crítico de solubilidade para U (e de temperatura crítica de solubilidade para TU), resulta disto mesmo por analogia com o ponto crítico das substâncias puras, onde duas fases (líquida e gasosa) também se tornam idênticas, com as mesmas propriedades. A Figura 2(b) ilustra um outro caso possível de imiscibilidade parcial de duas fases líquidas, onde agora o ponto L corresponde a uma temperatura crítica de solubilidade inferior. Abaixo da temperatura TL existe uma só fase líquida em toda a gama de composições. A curva binodal é limitada superiormente pelas suas intersecções com a curva dos pontos de bolha no equilíbrio (líquido + vapor). O caso representado na Figura 2(c), em que a curva binodal se fecha sobre si própria, com existência simultânea de dois pontos críticos, superior e inferior (U e L, respectivamente), é bastante mais raro: neste caso a imiscibilidade parcial das duas fases líquidas só pode ocorrer a temperaturas entre TU e TL. 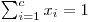 (ou, entre fracções mássicas,
(ou, entre fracções mássicas, 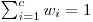 ).
).
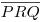 . A localização exacta do ponto representativo do sistema final R dependerá das massas relativas de P e Q que se misturarem. Se a uma mistura binária dos componentes 2 e 3 representada pelo ponto E, formos adicionando quantidades crescentes do componente 1 obtemos um sistema ternário cuja composição é representada por sucessivos pontos sobre a recta [1SE], uma vez que as proporções dos componentes 2 e 3 no sistema se mantêm. Quanto maior for a quantidade de componente 1 adicionada mais o ponto (S) que representa o sistema ternário se afastará da base, i.e. do ponto E, sobre o lado [23], e se aproximará do vértice 1, correspondente à substância que está a ser adicionada. Se, pelo contrário, partimos de um sistema ternário de composição dada por S e se dele formos removendo o componente 1 (por exemplo, por evaporação), a composição global do sistema vai evoluindo de modo que a sua representação se desloca sobre a recta [1SE] aproximando-se do ponto E.
. A localização exacta do ponto representativo do sistema final R dependerá das massas relativas de P e Q que se misturarem. Se a uma mistura binária dos componentes 2 e 3 representada pelo ponto E, formos adicionando quantidades crescentes do componente 1 obtemos um sistema ternário cuja composição é representada por sucessivos pontos sobre a recta [1SE], uma vez que as proporções dos componentes 2 e 3 no sistema se mantêm. Quanto maior for a quantidade de componente 1 adicionada mais o ponto (S) que representa o sistema ternário se afastará da base, i.e. do ponto E, sobre o lado [23], e se aproximará do vértice 1, correspondente à substância que está a ser adicionada. Se, pelo contrário, partimos de um sistema ternário de composição dada por S e se dele formos removendo o componente 1 (por exemplo, por evaporação), a composição global do sistema vai evoluindo de modo que a sua representação se desloca sobre a recta [1SE] aproximando-se do ponto E. 

![Diagrama ternário (T, wi) esquemático, a pressão constante. Até temperaturas pouco superiores a T3 os componentes 2 e 3 são parcialmente imiscíveis. A temperaturas superiores à do ponto P o sistema é homogéneo (monofásico). Retirado de [1].](images/stories/llefund6.png)
![Diagrama triangular em que os pares 1-3 e 1-2 são parcialmente imiscíveis. As rectas no interior das zonas bifásicas representam tie-lines. Retirado de [1].](images/stories/llefund7.png)
![Os pares 1-3 e 1-2 são parcialmente imiscíveis e as áreas de imiscibilidade mútua intersectam-se. As rectas no interior da zona bifásica são tie-lines. Retirado de [1].](images/stories/llefund8.png)
![Diagrama ternário (T, wi), esquemático, em que os pares (de líquidos) 1-2 e 1-3 são parcialmente imiscíveis até temperaturas ligeiramente abaixo de T´. Acima da temperatura T´e até T´´ a situação de imiscibilidade parcial só se observa para o par 1-2. Retirado de [1].](images/stories/llefund9.png)
![Diagrama triangular em que os componentes 1, 2 e 3 são parcialmente imiscíveis à temperatura considerada. As regiões A são monofásicas, as áreas B são bifásicas e o interior do triângulo C corresponde à coexistência de três fases (cujas composições são dadas pelos pontos a, b e c). Retirado de [1].](images/stories/llefund10.png)

![Diversos tipos de curvas de distribuição. O exemplo (c) é de um sistema solutrópico: a inclinação das tie-lines diverge, passando de positiva a negativa. No diagrama (b) não há ponto de enlace. Retirado de [1].](images/stories/llefund12.png)
![Diagrama ternário a temperatura constante. As linhas a tracejado são tie-lines. Retirado de [1].](images/stories/llefund13.png)