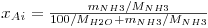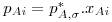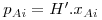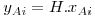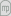Selecção do Solvente
Equilíbrio de fases
Equipamento
Projecto da Coluna
Bibliografia
A absorção de gases (designada em língua inglesa por “Gas Absorption” ou ainda por “Scrubbing”) é um processo com o qual se pretende remover preferencialmente um ou mais componentes de uma mistura gasosa por contacto com uma corrente líquida onde esses componentes se dissolvem. A operação inversa chama-se Desabsorção (“Desorption” ou “Stripping”), na qual um componente dissolvido num líquido passa para a fase gasosa. Embora a transferência de massa ocorra em direcções opostas os princípios físicos associados tanto à Absorção como à Desabsorção são os mesmos. O componente transferido de uma fase para outra é designado por Soluto, a corrente gasosa é composta pelo gás soluto e o Gás de Transporte (ou inerte), e a corrente líquida é constituída pelo Solvente e o soluto.
Os processos de Absorção e Desabsorção são muito usados para produção, separação e purificação de misturas gasosas e concentração de gases, na produção de ácidos (sulfúrico, clorídrico, nítrico e fosfórico), de amoníaco, de amónia, de formaldeído, de carbonato de sódio, no tratamento de gases de combustão do carvão e de refinarias do petróleo, na remoção de compostos tóxicos ou de odor desagradável (como o gás H2S), na purificação de gases industriais e na separação de hidrocarbonetos gasosos. Para regenerar o solvente, ou para obter a corrente gasosa na sua forma pura, pode elevar-se a temperatura ou pode usar-se vapor de água numa coluna de desabsorção, também designada coluna regeneradora (Fig. 1). Como exemplos, refira-se a absorção de NH3 em água (NH4OH) a partir do ar, seguido de elevação de temperatura para recuperação do NH3.
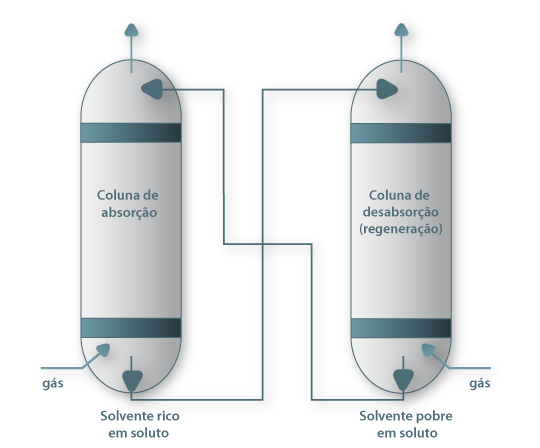 Figura 01: Absorção seguida de desabsorção para regeneração do solvente.
Figura 01: Absorção seguida de desabsorção para regeneração do solvente.
::: Início :::
Selecção do Solvente
O processo de Absorção/Desabsorção é um processo de transferência de massa que explora diferenças na solubilidade gás/líquido dos diferentes componentes de uma mistura que se pretende tratar. Por isso, um dos pontos críticos para se obter uma eficiente separação é a escolha do solvente (no caso da absorção) ou do gás de transporte (no caso da desabsorção) a usar. Se o objectivo principal for a produção de um composto específico, a selecção do solvente é restringida pela natureza do produto. No caso da remoção de impurezas de um gás, há maior liberdade de escolha. Como já se disse acima, um dos factores a considerar na escolha de um solvente é a solubilidade do soluto, devendo esta ser elevada para se obter uma maior velocidade de absorção e para necessitar de menor quantidade de líquido. Um outro factor é a natureza química do soluto e do solvente que devem ser semelhantes para aumentar a solubilidade. O solvente pode ser um líquido não reactivo e a solubilização do soluto é apenas um processo físico (forças de interacção de Van der Waals), ou pode ser um líquido que produz uma reacção rápida com o soluto o que faz aumentar a velocidade de absorção e a quantidade a ser absorvida. Este último tipo de solvente químico é usado, em geral, quando o soluto se encontra em baixas concentrações pois é um processo mais selectivo (maior solubilidade do soluto), mas a reacção deve ser reversível para que o soluto seja removido numa segunda coluna e não sejam produzidas grandes quantidades de resíduos. Um solvente reactivo é também usado quando se pretende converter um composto perigoso num composto mais inócuo.
A capacidade que um solvente tem de absorver um soluto gasoso A é função da sua pressão parcial CA=f(pA), sendo CA a concentração na fase líquida. Por isso, a absorção física é mais indicada para misturas mais concentradas (>pA). Esta relação funcional depende da temperatura e do tipo de solvente. Em geral, a solubilidade do gás diminui com a temperatura. Como exemplos, pode usar-se solventes físicos como o etilenoglicol ou o carbonato de propileno para remover tanto o gás H2S como o CO2 de correntes gasosas mais concentradas (~10 a ~50%), e, para concentrações mais baixas destes (~1 a ~10%, nomeadamente em gases de combustão), usar-se soluções aquosas de alcanolaminas (como a monoetanolamina, MEA, dietanolamina, DEA, ou a trietanolamina, TEA) que reagem reversivelmente com estes compostos. A regeneração pode ser feita por diminuição de pressão, no primeiro caso, ou por aumento de temperatura (para que o soluto vaporize) no segundo caso, originando, no entanto, maiores gastos energéticos. Se apenas houver quantidades vestigiais de H2S ou CO2, pode usar-se NaOH, que reage irreversivelmente. Na produção de amónia, por exemplo, uma corrente gasosa contendo ar e amoníaco é colocada em contacto com água onde o amoníaco é preferencialmente absorvido, uma vez que o ar é muito pouco solúvel em água. No controlo da poluição os vários óxidos de azoto podem ser removidos por absorção com água, ácido sulfúrico ou soluções orgânicas (Cussler, 1997, Strigle, 1987).
O solvente também deve ter baixa pressão de vapor (baixa volatilidade) para reduzir a perda de solvente para a corrente gasosa. Além disso, deve ter baixa viscosidade para a velocidade de absorção e a transferência de calor serem elevadas e os custos de bombagem serem baixos. Por fim, o solvente deve ser barato e acessível, não tóxico, não inflamável, estável quimicamente e não corrosivo para não encarecer o material de construção do equipamento. A maioria dos solventes físicos são solventes orgânicos com elevado ponto de ebulição e baixa pressão de vapor, baixa viscosidade e não corrosivos em contacto com metais comuns.
O processo de absorção é, em geral, exotérmico, sendo acompanhado pela libertação de calor. Neste portal será apenas abordado o caso da absorção/desabsorção de apenas um componente, considerando-se que os outros gases não são solúveis no líquido (inertes) e que o líquido não é volátil. Além disso, só se abordará a absorção física e isotérmica.
::: Início :::
Equilíbrio de Fases
Quando se coloca uma mistura gasosa em contacto com um líquido no qual um dos componentes é solúvel, como no caso do NH3 na Fig. 2, a composição do soluto no líquido vai evoluir até atingir um valor de equilíbrio dinâmico (isto é, quando igual número de moléculas de soluto passarem da fase gasosa para a fase líquida e no sentido inverso). Diz-se que se atingiu o valor da Solubilidade do soluto no líquido, para as condições em que foi realizada a experiência. A solubilidade do gás no líquido é uma função da natureza de ambos os componentes, da temperatura, da pressão parcial do gás na fase gasosa e da composição do líquido. A solubilidade diminui com a temperatura e aumenta, em geral, com a pressão total (até 5 atm). Usando diferentes valores de pressão parcial de NH3, no ensaio ilustrado na Fig. 2, obtêm-se diferentes valores de concentração na fase líquida. Pode-se assim construir uma tabela ou gráfico da chamada curva de equilíbrio, para diferentes temperaturas, e sistemas gás/líquido. É, no entanto, mais adequado usar para efeitos computacionais uma equação algébrica do tipo yi=f(xi) que descreva essa curva de equilíbrio. No caso da Fig. 2 basta aplicar a lei de Dalton para converter a pressão parcial de NH3 em fracção molar (ordenada do gráfico), enquanto a abcissa (mNH3/100 kgH2O) pode ser convertida em fracção molar pela equação 1, onde MNH3 é a massa molar do amoníaco:
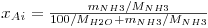 | (1) |
Para sistemas ideais (gás e líquido), as composições de equilíbrio estão relacionadas linearmente entre si sendo a constante de proporcionalidade o valor da pressão de vapor do soluto puro (p*A,σ) – esta relação é conhecida como a lei de Raoult e o seu formalismo matemático está apresentado na Eq.2 onde pAi é a pressão parcial do soluto na fase gasosa e xAi a fracção molar de soluto na fase líquida, ambas nas condições de equilíbrio. No entanto, a maioria das misturas não são ideais. Contudo, quando são usadas concentrações baixas (p.e. x<0,05), em parte delas verifica-se também uma dependência linear, esta descrita pela lei de Henry – Eq.3 ou 4. Chama-se a atenção para as unidades da constante de Henry (H) as quais dependem do formalismo usado para transcrever a lei de Henry. Para converter a Eq. 3 na Eq 4 basta dividir ambos os termos pela pressão total (lei de Dalton) pelo que a constante de Henry na Eq. 4 é independente da pressão total. Quando os gases são muito solúveis bastam pequenas pressões parciais no gás para se obterem concentrações elevadas no líquido, pelo que a constante de Henry tem um valor baixo, enquanto sucede o contrário para gases pouco solúveis (Fig 3). Como se pode ver, para sistemas que sigam a lei de Raoult ou a de Henry, a curva de solubilidade é uma recta, permitindo simplificar a metodologia de cálculo do dimensionamento das colunas como se verá nas secções seguintes.
 | (2) |
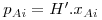 | [H´]=Pa.fracção molar-1 | (3) |
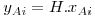 | [H]=fracção molar.fracção molar-1 | (4) |
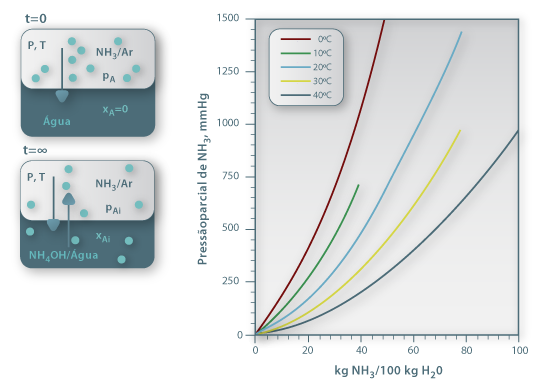
Figura 02: Dados de equilíbrio NH3/H2O a diferentes temperaturas (adaptado de International Critical Tables, 1929)
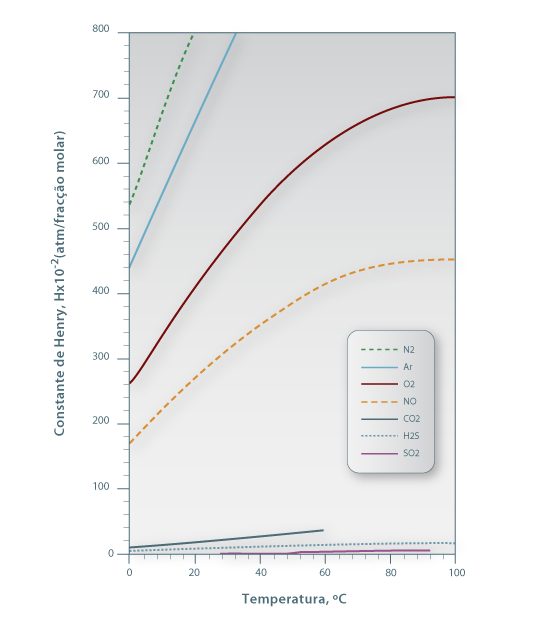
Figura 03: Efeito da temperatura e do tipo de gás soluto no valor da constante de Henry referente à solubilização em água (adaptado de International Critical Tables, 1929).
::: Início :::
Equipamento
A velocidade de transferência de massa depende, como se viu na secção “Transferência de Massa”, da área de transferência, da driving-force, e do coeficiente de transferência de massa.
A área para transferência de massa, ou área de contacto gás/líquido, pode ser aumentada por divisão das correntes líquida e/ou gasosa em pequenas porções. Isto é efectuado com recurso à passagem de gás pelos espaços vazios de um leito poroso cheio de material inerte (o enchimento), o qual está banhado de líquido, ou ainda à utilização de pratos com orifícios por onde passam pequenas bolhas de gás que estabelecem contacto com a corrente líquida no topo do prato como mostra a Fig. 4. Assim, este Processo de Separação é comum ser efectuado em colunas cilíndricas verticais (ou torres), sendo o objectivo deste portal o seu dimensionamento, isto é, a determinação do diâmetro da coluna e da altura de enchimento, num caso, e da determinação do número de pratos (ou andares) no outro. O enchimento pode ter diversas configurações como mostra a Fig. 5 (enchimento desordenado, como anéis de Raschig, de Lessing ou de Pall, Selas de Berl, etc, e enchimento ordenado ou estruturado) e os pratos podem ser de vários tipos: perfurados, de campânula, de válvulas, etc. Na secção Destilação/Interior da coluna são apresentados alguns exemplos destes dispositivos. Para promover o contacto contínuo gás/líquido pode ainda utilizar-se atomizadores (ou colunas de spray) e colunas de borbulhamento de gás.
Como se pode concluir pela análise do equipamento ilustrado na Fig. 4 o processo é influenciado pela mecânica dos fluidos, sendo o escoamento complexo e descrito largamente por correlações empíricas. A escolha do equipamento depende do caudal de gás a tratar, do grau de separação a obter, da razão entre os caudais de líquido e de gás, da facilidade da remoção de calor, da simplicidade de construção, da resistência hidráulica, da impureza dos fluidos, das propriedades físicas do sistema e da sua corrosividade. Para além destes factores, as colunas com enchimento permitem operar tanto em contra-corrente como em co-corrente, enquanto nas de pratos só é possível operar em contra-corrente (fluxos de gás e de líquido em direcções opostas). Contudo, é esta última condição de operação que permite maiores driving-forces. Remete-se para a Bibliografia, a listagem das vantagens e desvantagens de cada um destes equipamentos e em que circunstâncias uns devem ser preferidos a outros. De forma resumida adianta-se que a diferença de custo entre as colunas de pratos e de enchimento não é grande embora as últimas sejam mais caras. Estas são escolhidas quando o diâmetro é inferior a 0,6 m e quando é necessário menor queda de pressão ou maior variedade de materiais de construção. As primeiras são escolhidas quando não se tem de usar caudais de líquidos baixos e permitem maiores tempos de residência do líquido, controlo de temperatura (pelo uso de serpentinas) e são mais fáceis de limpar. Como regra, a coluna de pratos deve ser escolhida quando o diâmetro é elevado e quando é necessário mais de 20 andares.
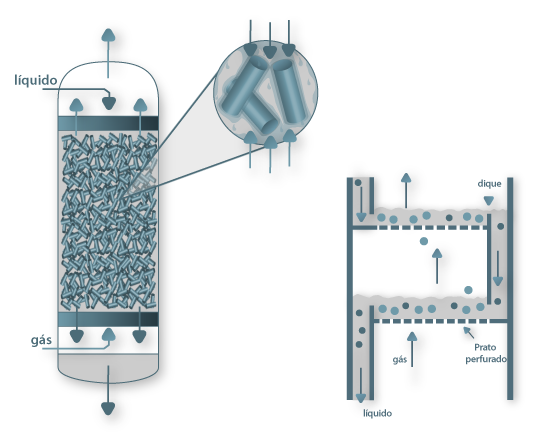
Figura 04: Coluna com enchimento e coluna de pratos perfurados (adaptado de Bird et al., 1969)

Figura 05: Exemplos de enchimentos – anéis de Raschig (vidro), anéis de Pall (metálicos) e anéis de Lessing (cerâmicos).
Quanto maior for o afastamento das condições de equilíbrio (driving-force), isto é, quanto menor for a quantidade de soluto no líquido relativamente ao máximo que é capaz de absorver (solubilidade), maior será a velocidade de absorção. Enquanto este dado termodinâmico estabelece o máximo de separação que é possível obter, o coeficiente de transferência de massa descreve a rapidez com que ocorre o processo de separação. Estes coeficientes são difíceis de prever uma vez que dependem das condições operatórias (T, P), da composição, das propriedades físicas de ambas as fases, da velocidade e do tipo de regime. Por isso, é comum recorrer a correlações empíricas obtidas experimentalmente para situações semelhantes, podendo, no entanto, o erro na sua estimativa ascender a 25%. A Absorção é um dos Processos de Separação à escala industrial onde se a utiliza mais intensivamente para a sua descrição analítica este conceito de coeficiente de transferência de massa desenvolvido na secção “Transferência de Massa”. No entanto, enquanto a absorção de gases numa coluna de enchimento é um exemplo de “contacto diferencial” (contínuo) que depende directamente dos coeficientes de transferência de massa, a absorção em colunas de pratos é um “contacto por andares” (descontínuo) onde se pressupõe a existência de equilíbrio entre fases, conceito este já definido na introdução aos Processos e Operações Unitárias .
::: Início :::
Projecto da Coluna
Os cálculos de projecto da coluna de absorção assentam em quatro princípios básicos que serão analisados mais em pormenor nas secções seguintes:
- extensão da separação (que afecta a altura da coluna – número de andares ou altura de enchimento); é necessário conhecer as condições de equilíbrio para o sistema e efectuar balanços mássicos; o custo da coluna é, em geral, logarítmico: remover 99% do soluto custa duas vezes mais do que remover 90% e duas vezes mais remover 99,9% do que 99%;
- o tempo de contacto ente fases que depende da velocidade de transferência de massa (eficiência do prato no caso do contacto por andares);
- a queda de pressão/caudais permitidos (que fixa o diâmetro da coluna);
- as necessidades energéticas (mecânicas e eléctricas) – bombagem dos fluidos, dispersão de líquidos e gases.
::: Início :::
Bibliografia
Apresenta-se a listagem da bibliografia referida em toda a secção “ABSORÇÃO” bem como a recomendada para aprofundar os conhecimentos do leitor neste Processo de Separação.
- R. B. Bird, W. E. Stewart, E. N. Lightfoot, "Transport Phenomena", John Wiley & Sons, Inc., New York, 1969 (existe uma 2ª ed. revista em 2007)
- A.K. Coker “Understand the Basics of Packed-Column Design” Chem Eng Progress 87(11), 93-99, 1991.
- E L Cussler “Diffusion Mass transfer in fluid systems” 2nd ed Cambridge University Press ,1997.
- J.M. Douglas, “Conceptual Design of Chemical Processes” McGraw-Hill Book Co. N.Y., 1988.
- J.S. Eckert “How Tower Packings Behave” Chem Eng. Ap. 14, 70-76, 1975.
- M. M. Figueiredo, "Absorção – Colunas de Enchimento", Cadernos de Eng. Química, 1, Departamento de Engenharia Química, Universidade de Coimbra, Coimbra, 1987.
- A. Foust et al., "Principles of Unit Operations", 2nd ed., Jonh Wiley and Sons, N.Y., 1980.
- C.J Geankoplis, “Transport Processes and Separation Process Principles (includes Unit Operations)”, 4th ed., Prentice-Hall, 2003.
- C.J Geankoplis, “Transport Processes and Unit Operations”, 3rd ed., Prentice-Hall, N.J.,1993.
- E. J. Henley e J. D. Seader “Equilibrium-Stage Separation Operations in Chemical Engineering”, John Wiley & Sons, New York, 1981.
- International Critical Tables, vol. III, E.W. Wishburn (ed.) National Research Council, McGraw-Hill Book Company, N.Y., 1929
- Kessler, Wankat, “Correlations for Column Parameters” Chem Eng, 1988, Sept 26, p.72
- H.Z. Kister, D.R. Gill, “Predict Flood Point and Pressure Drop for Modern Random Packings” Chem Eng, Progress 87(Feb), 32-40, 1991.
- E.E. Ludwig, “Applied Process Design for Chemical and Petrochemical Plants” 2nd ed, vol2, Gulf Publ., Houston, 1979 (existe uma 3ª ed. de 1997)
- W. McCabe, J. Smith and P. Harriott “Unit Operations of Chemical Engineering” 7th ed. McGraw-Hill Inc., N.Y., 2005.
- R.H. Perry, D.W. Green, (eds) “Perry´s Chemical Engineers´Handobook”, 7th ed., McGraw-Hill, N.Y., 1997.
- J.F. Richardson, J.H. Harker, J.R. Backhurst “Coulson & Richardson´s Chemical Engineering” Vol.2", 5th ed.,Butterworth-Heinemann, Oxford, 2002.
- Schweitzer, P.A. (ed) “Handbook of Separation Techniques for Chemical Engineers”, McGraw-Hill Book Company, N.Y.,1979.
- J.D. Seader and E.J. Henley “Separation Process Principles” 2nd ed. John Wiley & Sons, 2006.
- W.D. Seider, J.D. Seader, D.R. Lewin “Process Design Principles: Synthesis, Analysis and Evaluation”, John Wiley & Sons, New York, 1998.
- W.D. Seider, J.D. Seader, D.R. Lewin “Product & Process Design Principles: Synthesis, Analysis and Evaluation”, 2nd ed. John Wiley & Sons, New York, 2004.
- T.K.Sherwood, R.L. Pigford, C.R. Wilke “Mass Transfer”, McGraw-Hill Book Company, N.Y., 1975.
- R.F. Jr Strigle “Random Packings and Packed Towers” Gulf Publishing Co, Houston, 1987.
- R.E. Treybal “Mass Transfer Operations”, 3rd ed. McGraw-Hill, N.Y., 1980
- R.E. Treybal “Mass Transfer Operations”, 2nd ed. McGraw-Hill, N.Y., 1968
- S.M. Walas “Rules of Thumb”, Chem. Eng., 1987, March 16, p.75-81
- P. C. Wankat, “Equilibrium Staged Separations”, Elsevier Publishing Co., Inc., New York, 1988.
- P. C. Wankat, “Separation Process Engineering”, 2nd ed., Prentice-Hall, 2007.
http://www.separationprocesses.com
http://www.koch-glitsch.com/koch/products/random_packing.asp
http://www.jaeger.com/randompkg.htm
http://www.norpro.saint-gobain.com/
::: Início :::





 Figura 01: Absorção seguida de desabsorção para regeneração do solvente.
Figura 01: Absorção seguida de desabsorção para regeneração do solvente.