Caso de estudo: reacção homogénea em fase líquida do acetato de etilo com o hidróxido de sódio
Método Integral
Método Diferencial
Este caso de estudo corresponde a uma das experiências consideradas nos Laboratórios Virtuais, podendo tratar-se nesta secção os resultados experimentais que se obtêm naquela experiência. Neste caso, considera-se que a velocidade de reacção é dada por:
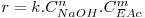 | (1) |
sendo k a constante cinética, n a ordem da reacção em relação ao hidróxido de sódio, m a ordem da reacção em relação ao acetato de etilo, CNaOH a concentração do hidróxido de sódio e CEAc a concentração do acetato de etilo. O utilizador pode estimar os parâmetros cinéticos (k, n, m, E, k0) para esta reacção a partir dos resultados experimentais apresentados na secção dos Laboratórios Virtuais , pelo método diferencial ou pelo método integral.
::: Início :::
Método Integral
Neste caso o utilizador deve arbitrar as ordens parciais da reacção n e m, podendo ser simulados os casos em que: n=0 e m=0, n=1 e m=1, n=0 e m=1, n=1 e m=0, n=1.5 e m=1.5.
As equações integradas e linearizadas que resultam destas combinações de valores são:
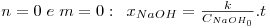
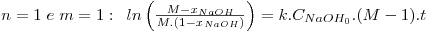
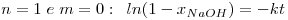
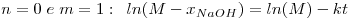
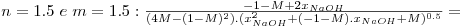
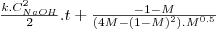
onde 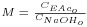 , CNaOHo é a concentração inicial de hidróxido de sódio e CEAco é a concentração inicial de acetato de etilo; xNaOH é a conversão do hidróxido de sódio [(CNaOHo-CNaOH)/CNaOHo]. Uma vez determinado o valor de k, para os valores de n e m arbitrados, é possível fazer a validação do modelo, calculando para cada tempo, o valor da conversão prevista pelo modelo, através das equações:
, CNaOHo é a concentração inicial de hidróxido de sódio e CEAco é a concentração inicial de acetato de etilo; xNaOH é a conversão do hidróxido de sódio [(CNaOHo-CNaOH)/CNaOHo]. Uma vez determinado o valor de k, para os valores de n e m arbitrados, é possível fazer a validação do modelo, calculando para cada tempo, o valor da conversão prevista pelo modelo, através das equações:
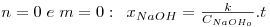
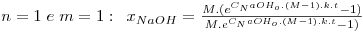
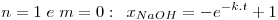
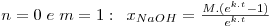
A Fig.1 mostra a linearização dos resultados experimentais obtidos para T=15ºC, quando se arbitra n=1 e m=1, sendo possível, através do método integral, estimar a constante cinética. Os resultados experimentais obtidos para T=20ºC e T=25ºC, também podem ser analisados de modo similar.
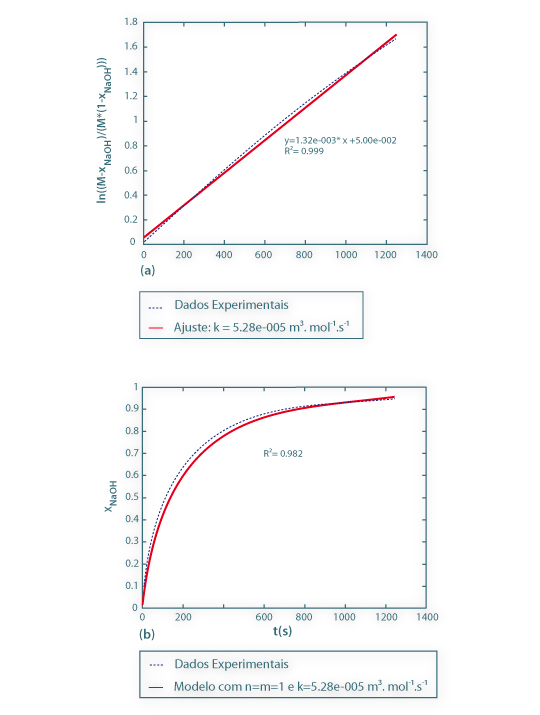
Figura 1 – (a) - Estimativa da constante cinética, a partir do método integral, para T=15ºC; b) - validação do modelo.
::: Início :::
Método Diferencial
Como neste caso não foi utilizado o método do reagente em excesso, a estimativa dos parâmetros cinéticos através do método diferencial está limitada ao caso em n=m, e a linearização da equação da velocidade de reacção é:
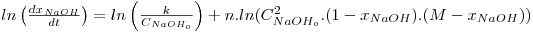 | (2) |
Por regressão linear desta equação, obtêm-se os valores de k e de n.
Para conhecer o valor da derivada 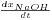 , aproximam-se os valores experimentais de xNaOH versus t a um polinómio de 5º ordem, e calcula-se analiticamente a derivada desse polinómio.
, aproximam-se os valores experimentais de xNaOH versus t a um polinómio de 5º ordem, e calcula-se analiticamente a derivada desse polinómio.
Como para este caso de estudo se obtém n=1, a validação do modelo é feita calculando para cada tempo, o valor da conversão do hidróxido de sódio, dada por:
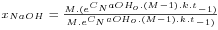 , com k obtido pela regressão linear.
, com k obtido pela regressão linear.
A Fig.2(a) ilustra a aplicação do método diferencial para uma temperatura de 20ºC, e na Fig.2(b) coloca-se em evidência as previsões obtidas pelo modelo face a um conjunto de resultados experimentais (validação do modelo).
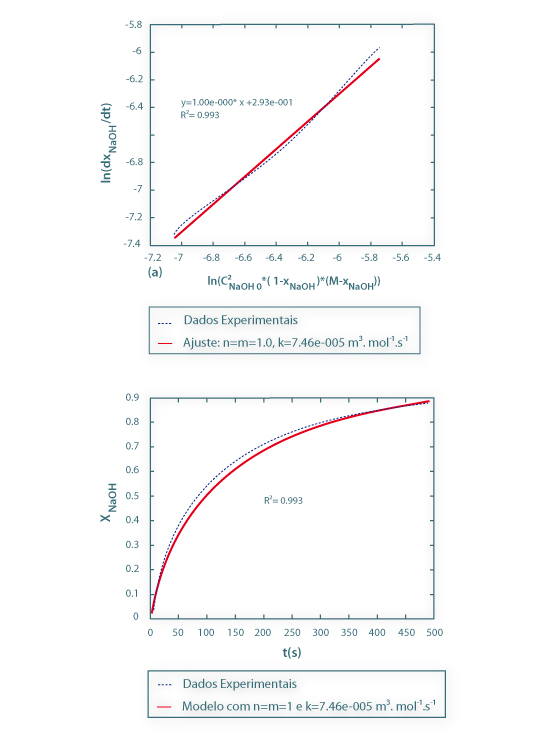 Figura 2 – (a) - Estimativa de parâmetros cinéticos (k), a partir do método diferencial, para T=20ºC; (b) - validação do modelo.
Figura 2 – (a) - Estimativa de parâmetros cinéticos (k), a partir do método diferencial, para T=20ºC; (b) - validação do modelo.
Como os resultados experimentais deste caso de estudo se referem a três temperaturas distintas (15ºC, 20ºC e 25ºC), a energia de activação e o factor de frequência podem ser estimados por ajuste da lei de Arrhenius, e a Fig.3 evidencia o bom ajuste que pode ser obtido neste caso.
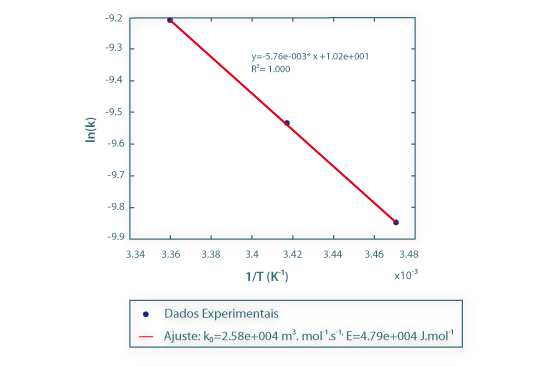
Figura 3 – Estimativa do factor de frequência, k0, e da energia de activação, E, por ajuste da lei de Arrhenius.
::: Início :::








