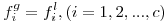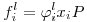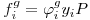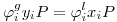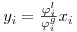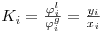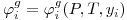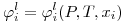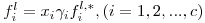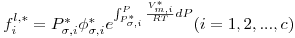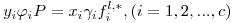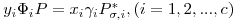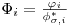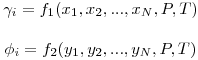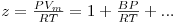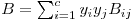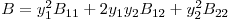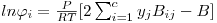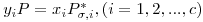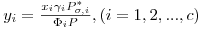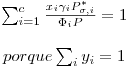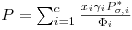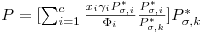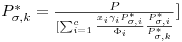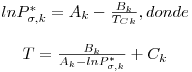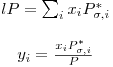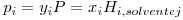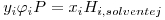Determinacão de equilíbrio líquido-vapor (ELV) por métodos homogéneos
Determinacão de VLE por métodos heterogéneos
Ilustração de um cálculo do tipo BUBLT
Solubilidade de gases
Bibliografia
Determinacão de equilíbrio líquido-vapor (ELV) por métodos homogéneos
Seja um sistema de c componentes constituído por uma fase liquída em equilíbrio com a fase gasosa à temperatura T e à pressão P. A composição da fase líquida é dada pelas fracções molares {xi}e a da fase gasosa por {yi}. As equações da termodinâmica que traduzem o equilíbrio entre as fases líquida e gasosa num sistema de c componentes, são
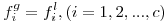
| (1) |
onde fi designa a fugacidade do componente i na mistura e os índices g e l se referem à fases de vapor (ou gás) e líquida respectivamente. Fazendo intervir o coeficiente de fugacidade de i na fase liquída , φil virá
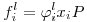
| (2) |
enquanto que para o gás, entrando com o coeficiente de fugacidade do gás, vem
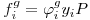
| (3) |
Tendo em consideração as (c) eqs. (1) tem-se que
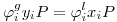 | (4) |
As eqs. (4) podem ser escritas na forma equivalente
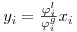
| (5) |
ou, também,
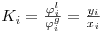 | (6) |
O quociente Ki=(yi/xi) é denominado razão de equilíbrio do componente i. K é uma medida da volatilidade do componente i: se Ki for maior que a unidade (yi>xi) o componente i tende a acumular-se na fase de vapor; se for menor, o componente i tem tendência a concentrar-se na fase líquida. No primeiro caso (Ki>1) diz-se que i é um componente leve; se Ki<1 diz-se que i é um componente pesado.K é função da temperatura, da pressão, da composição e da natureza dos componentes da mistura. Nas equações anteriores,
e
As equações 2 a 4 indicam que o tratamento das duas fases é efectuado do mesmo modo e por esta razão a forma de abordar o problema do cálculo do equilíbrio líquido+vapor é denominada modelo homogéneo.
O conhecimento dos coeficientes de fugacidade dos componentes da mistura líquida e gasosa pode ser realizado a partir de uma equação de estado aplicável simultaneamente à fase líquida e à fase de vapor. Um exame liminar das eqs. (2) a (4) permite concluir que o cálculo dos coeficientes de fugacidade tem que ser feito recorrendo a métodos iterativos. Dada a importância dos dados (T, x, y) no projecto de equipamento de separação líquido/gás esquematiza-se na Figura 1 o tratamento de um problema do tipo BUBLT: os dados são P e as fracções molares na fase líquida {xi}e as incógnitas são T e a composição da fase gasosa dada pelas fracções molares {yi}. O cálculo dos coeficientes de fugacidade necessita do conhecimento da temperatura que é uma incógnita e o cálculo do coeficiente de fugacidade do gás exige que se conheçam quer a temperatura quer as fracções molares composição do gás {yi}. A situação é semelhante nos outros tipos de cálculo do VLE que exigem estratégias de abordagem e procedimentos iterativos diferentes.
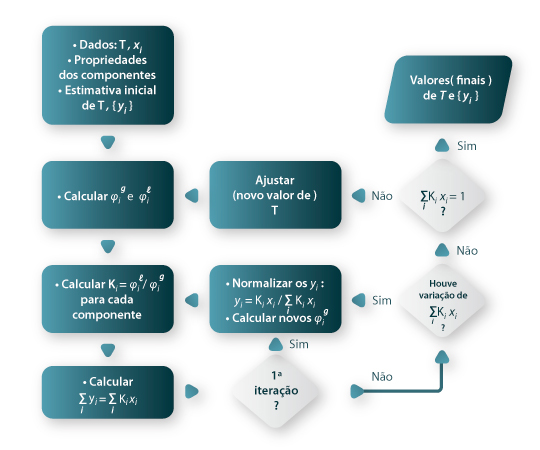
Figura 01: Fluxograma para o cálculo BUBLT pelo modelo homogéneo.
::: Início :::
Determinacão de VLE por métodos heterogéneos
Seja um sistema de c componentes constituído por uma fase liquída em equilíbrio com uma fase gasosa à temperatura T e à pressão P. As equações da termodinâmica que traduzem o equilíbrio entre as fases líquida e gasosa num sistema de c componentes são as c eqs. (1). A fugacidade da fase gasosa é dada pela eq. (3), enquanto que a fugacidade do componente i na fase líquida é traduzida por
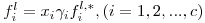 | (7) |
onde γ i designa o coeficiente de actividade do componente i (na fase líquida) e fil,* é fugacidade do líquido puro i nas condições (P, T) da mistura líquida. É
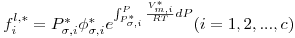 | (8) |
onde Vm,i*,l é o volume molar do componente i nas condições (P, T) da mistura, Pσ,i* é a pressão de vapor do componente puro i à temperatura T e φσ,i* é o coeficiente de fugacidade do líquido saturado (ou do gás saturado). O termo exponencial é designado por correcção de Poynting.. Deste modo de acordo com a equação (1) igualando a equação (3) com a equação (7) virá
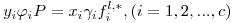
| (9) |
Para líquidos puros verifica-se que a correcção de Poynting pode considerar-se igual à unidade desde que a pressão de vapor dos componentes puros não difira significativamente entre si à temperatura T de equilíbrio.
Virá então
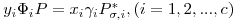
| (10) |
onde
Ao todo existem 2c variáveis em jogo (c-1 fracções molares para a fase líquida, c-1 fracções molares para a fase gasosa, P e T- quer dizer 2(c-1)+2 = 2c variáveis - e temos c equações da forma (9 ou 10). Assim, num dado problema de cálculo VLE é necessário fixar o valor de c variáveis (propriedades) enquanto que os valores das restantes c variáveis (propriedades) são determinados pelas c equações do tipo (9). Relativamente à depedência do coeficiente de actividade e do coeficiente de fugacidade em termos de P, T e composição temos que
e, consequentemente a resolução de problemas de VLE é feita recorrendo a técnicas de iteração.
O valor do coeficiente de actividade, γi, é calculado a partir de modelos apropriados alguns dos quais são modelos preditivos.Entre estes merece especial relevo o método UNIFAC que é aplicado aqui aos cálculos VLE. Este método utiliza o conceito da contribuição e grupos segundo o qual cada molécula constituinte da mistura líquida é composta por grupos apropriados cabendo a cada um volume e uma área superficial.Para além disso consideram-se as interacções entre diferentes grupos de forma a serem contabilizadas as forças intermoleculares. O valor do coeficiente de fugacidade do componente i no vapor é determinado por aplicação de uma equação de estado apropriada à fase gasosa. Para uma mistura gasosa perfeita (gás perfeito) φi=1. Para pressões baixas e moderadas (densidades moderadas), a equação de estado dos gases perfeitos é inadequada para descrever o comportamento PVT do gás. Nestas condições utiliza-se a equação de virial truncada no segundo termo (forma de Berlin):
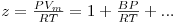 | (11) |
onde B é o segundo coeficiente de virial (que depende apenas da temperatura e da composição, independente da pressão e do volume). Para uma mistura gasosa de c componentes, B é dado por
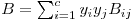
| (12) |
onde Bij (=Bji ) depende apenas da temperatura.Para uma mistura binária, pode ver-se facilmente que
O coeficiente de fugacidade φi relativo à eq. (11) é
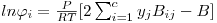 | (13) |
Uma simplificação importante da eq. (10) obtém-se quando a fase líquida é ideal ( neste caso γi=1) e a fase gasosa é uma mistura gasosa perfeita a que corresponde Φi=1. Obtém-se que
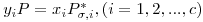 | (14) |
expressão que traduz a lei de Raoult.O produto (yi P) designa-se por pressão parcial, pi.
Dada a maior importância relativa dos diagramas (T, x, y) e mais propriamente s do tipo (y, x) no projecto do equipamento de separação líquido/gás ilustra-se aqui o cálculo de um diagrama deste tipo - realizado por exemplo através de um cálculo de BUBLT.
::: Início :::
Ilustração de um cálculo do tipo BUBLT
Explicitando (10) em ordem a yi,
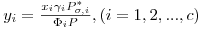
| (15) |
quer dizer
ou, ainda de forma equivalente,
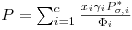
| (16) |
A equação anterior pode ainda escrever-se na forma
onde Pσ,k* é a pressão de vapor de um componente puro k, à temperatura T de equilíbrio. Podemos também escrever
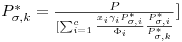 | (17) |
Dada uma equação da pressão de vapor para o componente k, genéricamente do tipo Pσ,k* = f (T) ela pode ser resolvida em ordem a T conhecendo Pσ,k*. Uma forma analítica muito conveniente que permite uma rápida explicitação em T é a conhecida equação de Antoine,
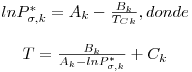 | (18) |
As eqs. (15) a (18) são utilizadas nos cálculos de BUBLT.
Para o caso da lei de Raoult as eqs. (15) e (16) vêm
Na Figura 2 está esquematizado um fluxograma para o cálculo de BUBLT.
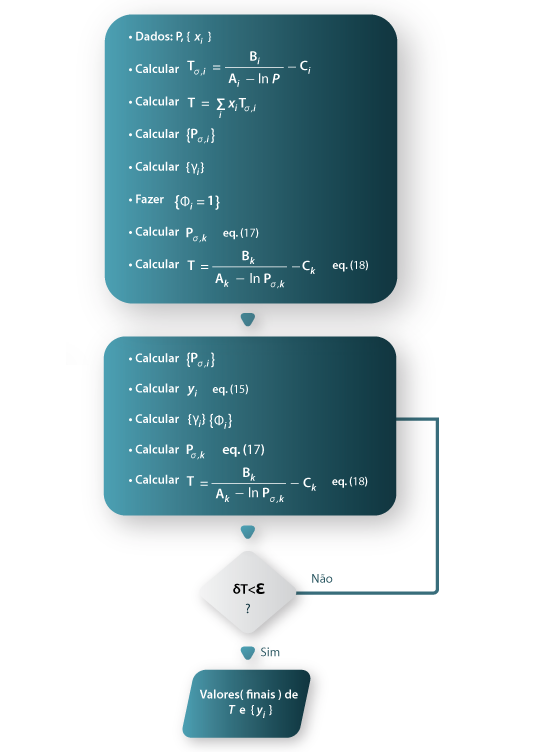
Figura 02: Um fluxograma para o cálculo de BUBLT pelo método heterogéneo
Cabe ainda referir que o módulo VLE efectua todos os cálculos de equilíbrio utilizando os algoritmos dados por Smith e Van Ness [1].
::: Início :::
Solubilidade de gases
Um caso particular do VLE é aquele em que um gás se dissolve num líquido. O estudo deste fenómeno é muito importante quando se trata por exemplo de separar uma mistura gasosa por absorção: diferentes gases (solutos) dissolvem-se num líquido (solvente) em quantidades diferentes. A solubilidade de um gás num líquido é determinada com base nas eqs. (1). Observa-se também que a solubilidade de um gás (soluto i) num líquido (solvente j) é muitas vezes proporcional á sua pressão parcial na fase gasosa. A equação que descreve esta observação é a lei de Henry:
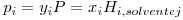
| (19) |
onde Hi, solvente j é a constante de Henry. A constante de Henry não depende da composição da mistura líquido+gás, só depende da temperatura e é fracamente dependente da pressão. A eq. (19) é válida admitindo que a fase gasosa é uma mistura gasosa perfeita e que a fase gasosa é ideal. A lei de Henry constitui um modelo para uma mistura líquida ideal. Caso não se possa considerar a fase gasosa como perfeita pode escrever-se
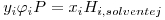
| (20) |
uma expressão análoga à eq. (9), desde que se considere
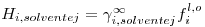 | (21) |
onde γi∞ designa o coeficiente de actividade de i no solvente j a diluição infinita e fil,o é a fugacidade do soluto na fase líquida num estado padrão (º).
Cálculo de coeficientes de actividade pelo método UNIFAC
Quando não se conhecem valores experimentais da função de Gibbs de excesso (ou, o que é o mesmo, dos coeficientes de actividade dos componentes da mistura) é importante dispor de outros métodos de estimativa que proporcionem, pelo menos, o seu conhecimento aproximado. Recorre-se fequentemente aos métodos de contribuição de grupos. No caso dos coeficientes de actividade um método muito generalizado de estimativa é o método UNIFAC (UNIversal Functional Activity Coefficient) proposto em Berkeley por Fredenslund et al.,[2]. Este método pode encontrar-se descrito na generalidade dos textos recentes de Termodinâmica e numa detalhada monografia[3]. Apresenta-se aqui, apenas, o fundamento desta técnica de estimativa sugerindo-se a leitura da monografia [3] para um conhecimento mais detalhado da teoria. O método UNIFAC admite que o coeficiente de actividade do componente i de uma mistura líquida resulta de duas contribuições: uma contribuição combinatorial (ou contribuição entrópica) e uma contribuição residual:
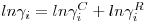
| (1) |
A contribuição combinatorial, γiC, diz respeito às diferenças de tamanho e de forma das moléculas, sendo calculada a partir de propriedades da substância pura. A contribuição residual, γiR, que resulta das forças intermoleculares, depende das áreas dos grupos que constituem as moléculas e das interacções entre eles, sendo determinada a partir de propriedades das misturas. O método UNIFAC supõe que a mistura líquida é uma solução das unidades estruturais (denominadas grupos e subgrupos) que constituem as moléculas em vez de a considerar como uma mistura das próprias moléculas.
As propriedades dos subgrupos, que estão tabeladas [4], são: um parâmetro de volume, Rk , e um parâmetros de área, Qk , com os quais se determinam as contribuições combinatoriais, ln γiC. Para além disto é preciso dispor, ainda, dos parâmetros (amk) de interacção entre subgrupos m e k, valores que se encontram também tabelados e com os quais se calculam as contribuições residuais, ln γiR. Sempre que uma molécula particular possa ser decomposta em mais do que um conjunto de subgrupos, deve considerar-se o conjunto a que corresponda o menor número de subgrupos diferentes. A monografia [3] apresenta programas computacionais para os cálculos de (VLE) e (LLE) com o método UNIFAC apresentando rotinas para o cálculo dos coeficientes de actividade.
::: Início :::
Bibliografia
[1] Smith, J. M., van Ness, H. C. Introduction to Chemical Thermodynamics, 4 th. ed. Mc Graw-Hill, new York, 1987.
[2] A. Fredenslund, R. L. Jones, J. M. Prausnitz, AIChE Journal, 21 (1975) 1086
[3] A. Fredenslund, G. Gmehling, P. Rasmussen, Vapor-liquid equilibria using UNIFAC, Elsevier, Amesterdam, 1977.
4] B. E. Poling, J. M. Prausnitz, J. P. O´Connell, The properties of gases and liquids, 5th ed., McGraw-Hill, New York, 2001
::: Início :::