As reacções químicas
Reacções homogéneas e reacções heterogéneas
Reacções reversíveis e reacções irreversíveis
Reacções endotérmicas, exotérmicas e atérmicas
Bibliografia
As reacções químicas
Quando nos interrogamos sobre o papel da Engenharia Química no nosso Mundo a resposta tem sempre a ver com a transformação de matérias-primas em produtos muito variados. Estes produtos permitem assegurar desde as necessidades mais básicas para o Homem como a alimentação (os fertilizantes melhoram a produtividade dos campos agrícolas e os pesticidas são fundamentais no controlo de pragas que ameaçam as culturas), até à construção de satélites e sua colocação em órbita usando combustíveis especiais, ou mesmo as formas de comunicação rápidas que usamos hoje em dia.
“A Engenharia Química põe as Moléculas a trabalhar para nós”

A transformação das moléculas em produtos, ou outras moléculas diferentes, acontece através de reacções químicas em que se quebram umas ligações para se estabelecerem outras ligações químicas. Mas não são apenas as moléculas que estão envolvidas nas reacções, estas também podem ocorrer entre iões ou entre átomos. No entanto é bom salientar que não é possível estabelecer ligações entre todos os elementos da tabela periódica.
Nas condições normais de pressão e temperatura algumas reacções químicas são espontâneas, o que significa que ocorrem naturalmente, sem intervenção exterior, como acontece nos processos de corrosão de metais. Para que uma reacção química ocorra de modo espontâneo a energia livre envolvida tem que ser negativa, ver Figura 1. De referir que o facto de uma reacção ser espontânea não está relacionado com a velocidade a que ocorre essa reacção química. Recorrendo de novo à corrosão de metais, as reacções envolvidas são lentas, nas condições normais de pressão e temperatura (T= Tambiente e P = 1atm).
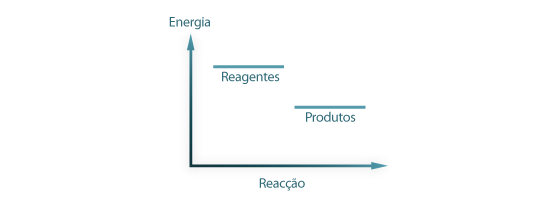 Figura 1: Relação entre a energia química de reagentes e produtos numa reacção espontânea.
Figura 1: Relação entre a energia química de reagentes e produtos numa reacção espontânea.
Outras reacções químicas são “mais exigentes”. Para que aconteçam e haja transformação em novas moléculas devem ser criadas condições particulares no sistema ou reactor. Estas condições têm a ver com a temperatura, a pressão, a composição, o pH, …. E é preciso não esquecer que algumas reacções só ocorrem na presença de catalisadores.
Os catalisadores podem desempenhar um papel muito importante. Ao baixarem a energia de activação da reacção estão a facilitar a sua ocorrência. Podem assim privilegiar essa reacção em detrimento de outra (ou outras), uma vez que as reacções raramente ocorrem isoladamente, mas sim em série ou em simultâneo. O catalisador aumenta a velocidade da reacção química.
As reacções químicas podem ter características muito diversas e existem vários critérios para a sua classificação.
::: Início :::
Reacções homogéneas e reacções heterogéneas
Dependendo do número de fases presentes a reacção pode ser homogénea ou em fase homogénea, ou heterogénea, se os compostos químicos envolvidos estiverem em mais de uma fase.
As reacções de neutralização ácido-base e as reacções de combustão de combustíveis gasosos são bons exemplos de reacções homogéneas, as primeiras em fase líquida, as segundas em fase gasosa.
Por outro lado, a combustão de carvão e as reacções de minimização de poluentes nos gases de escape dos motores dos veículos (gás-sólido nos dois casos), a absorção de dióxido de carbono em meio alcalino (gás-líquido), as reacções para redução de dureza da água (líquido-sólido) ou a liquefacção do carvão (gás-líquido-sólido) são alguns exemplos de reacções heterogéneas.
Durante uma reacção também pode ocorrer mudança de fase:

Figura 2: Reacção entre moléculas de hidrogénio e oxigénio dando origem a uma molécula de água.
::: Início :::
Reacções reversíveis e reacções irreversíveis
Quando uma reacção se dá apenas num sentido, reagentes dando origem a produtos, a reacção é irreversível. Uma reacção química diz-se reversível quando pode ocorrer nos dois sentidos, isto é, os reagentes dão origem a produtos mas estes também podem reagir vindo a formar-se os reagentes iniciais. Um dos exemplos de interesse industrial é a reacção de produção de amoníaco a partir de azoto e hidrogénio:
Às reacções reversíveis está associado um estado de equilíbrio químico, que depende das concentrações iniciais dos reagentes e das condições em que estas decorrem. Do ponto de vista macroscópico, quando se atinge o estado de equilíbrio não se registam transformações, o que significa que a concentração dos reagentes e dos produtos se mantém constante. No entanto, as reacções estão a acontecer nos dois sentidos, mas a igual ritmo.
O estado de equilíbrio químico que é atingido está relacionado com a constante de equilíbrio do sistema, e esta depende da temperatura. Foi Henri Le Chatelier quem, no século XIX, traduziu a resposta dos sistemas em equilíbrio a perturbações:
“Um sistema em equilíbrio responde a qualquer perturbação com uma alteração que tende a contrariar a perturbação a que foi sujeito.”
Este enunciado passou a ser designado por Princípio de Le Chatelier.
Reacções endotérmicas, exotérmicas e atérmicas
Esta classificação tem como critério a transferência de energia com o exterior durante a reacção. Esta energia manifesta-se sob a forma de calor. Quando a reacção recorre a energia do exterior diz-se endotérmica. No caso oposto, se transfere energia para o exterior, é uma reacção exotérmica. Reacção atérmica é aquela que não utiliza nem liberta energia para o exterior.
O calor de reacção ou entalpia de uma reacção, ΔHr, é definido para condições de pressão e temperatura constantes. Sendo a reacção levada a cabo num sistema fechado a pressão e temperatura constantes, a entalpia de reacção representa o calor libertado ou absorvido para que a temperatura do sistema se mantenha constante.
Do que acabou de ser dito vem:
ΔHr < 0 Reacção exotérmica
ΔHr > 0 Reacção endotérmica
ΔHr = 0 Reacção atérmica
Bibliografia:
- Levenspiel, O., “Chemical Reaction Engineering”, 3rd ed., John Willey & Sons., N.Y. (1999).
Endereços na Internet:
- http://nautilus.fis.uc.pt/wwwqui/equilibrio/port/Welcome.html
- http://nobelprize.org/nobel_prizes/chemistry/laureates/1903/
- http://www.chem4kids.com/files/react_intro.html








