1. Introdução
1.2 História
1.3 Características dos Biocatalisadores
1.4. Biocatálise vs Catálise Química
2. Cinética de Michaelis Menten
2.1 Fundamentos Cinéticos (Reacções em fase aquosa)
2.2 Estimativa dos parâmetros cinéticos
2.3 Inibição da actividade enzimática
2.3.1 Inibição pelo substrato
2.3.2 Inibição competitiva
2.3.3 Inibição não-competitiva
2.3.4 Inibição incompetitiva
2.4 Mecanismos
2.5 Bases cinéticas da selectividade
3. Imobilização
3.1 Transferência de massa
3.1.1 Efeitos de Resistência Externa à Transferência de Massa
3.1.2 Efeitos de Resistência Interna à Transferência de Massa
3.1.3 Efeitos Simultâneos das Resistências Externa e Interna à Transferência de Massa
1. Introdução
A produção de mercadorias e bens de alto valor acrescentado por via biotecnológica requer a utilização de catalisadores biológicos e o desenvolvimento de processos para a sua manufactura é objecto da biocatálise aplicada.
Pode definir-se biocatálise aplicada de um modo razoavelmente claro e aceitável como sendo "a aplicação de um biocatalizador de modo a atingir uma dada conversão sob condições controladas num biorreactor". Contudo, uma tal definição carece de aprofundamentos: de facto, o próprio conceito de biocatalisador não se restringe apenas ao âmbito dos enzimas, incluindo também hoje agentes tão diversos como células, organitos celulares, ribozimas, ou anticorpos catalíticos (abzimas); além disso, são hoje também mais diversificados os campos de aplicação, as tecnologias envolvidas e as escalas de aplicação. Sem dúvida que os enzimas e as células são, por demais, os de maior utilização.
Aceitando aquela definição deve, porém, fazer-se o contraste para não confundir com o que é a fermentação que, por sua vez, poderá definir-se como a produção, em resultado da actividade metabólica, de uma enorme e complexa variedade de produtos, incluindo a biomassa, sem qualquer semelhança ou afinidade estrutural com os compostos orgânicos fornecidos a agentes microbianos. Num processo dito de biocatálise, por contraste, apenas um ou poucos tipos de modificações são introduzidas, em oposição à actividade metabólica nas fermentações.
No domínio da biocatálise identificamos ainda a sub-área das biotransformações, de âmbito mais restrito mas extremamente importante, e que consistem em "modificações enzimáticas selectivas de compostos puros com formação de produtos finais bem definidos". Mas também aqui é de enfatizar que o biocatalisador não se restringe hoje à classe dos enzimas.
As aplicações são hoje já muito extensas, podendo referir-se
- Detergentes e produtos de lavagem
- Indústria farmacêutica
- Indústria de rações animais
- Aplicações analíticas
- Indústrias alimentares (lacticínios, cerveja, vinhos, sumos, panificação, óleos e gorduras, carnes, …)
- Indústrias de pasta e papel
- Têxteis
- Curtumes
- Indústria do amido
- Indústria de antibióticos
- Química fina
::: Início :::
1.2 História
Numa perspectiva histórica, a Biocatálise Aplicada terá tido as suas raízes no extremo oriente, na China e no Japão; na Europa radica as suas origens na Grécia Antiga onde se terá fabricado queijo precipitando a caseína com galho de figueira (que produzia ficina, uma protease). O seu desenvolvimento com bases científicas só viria, porém, a iniciar-se já no início do século XX, sendo marcantes algumas:
- Já na primeira metade do séc. XIX, em 1833, se extraiu a glucoamilase a partir de malte germinado, então com a designação de diastase.
- O Séc. XIX foi dominado pelo debate sobre a ligação entre catalisadores biológicos e a vida (células), sendo particularmente conhecida a escola de Pasteur. Porém, em 1897, um extracto de levedura (Zymase) permitiu a fermentação da glucose, com produção de álcool e CO2.
- Mas a indústria de enzimas começa, por assim dizer, em 1874 na Dinamarca onde o químico Christian Hansen produziu uma preparação enzimática estandardizada de quimiosina extraída com soluções salinas do 4º estômago de ruminantes.
- A primeira produção e aplicação industrial a emergir, já no séc. XX, dos trabalhos de Takamene foi de amilases (Takadiastases) fúngicas de Aspergillus oryzae, por fermentação de superfície ou em meio semi-sólido, em arroz demolhado ou farelo de trigo.
A produção industrial em larga escala só viria, no entanto, a iniciar-se já na década de 50 do século XX, com os desenvolvimentos na tecnologia de cultura submersa, com a glucoamilase (1955), existindo hoje uma vasta gama de enzimas comercialmente utilizados com os mais diversos fins. As fontes de enzimas são diversas: animais e plantas, mas os enzimas de uso industrial são, sobretudo, de origem microbiana.
É de salientar a liderança europeia neste domínio, sendo a NOVO Nordisk, sediada na Dinamarca, a maior companhia mundial de produção de enzimas.
::: Início :::
1.3 Características dos Biocatalisadores
Mas pode perguntar-se: o que é que afinal existe de especial num biocatalisador para uma expansão tão acentuada em aplicações tão diversificadas? As principais características intrínsecas geralmente salientadas em favor relativamente à catálise química incluem:
- elevado poder catalítico (Turnover elevado)
- elevada especificidade (relativamente a: natureza da reacção, natureza do substrato, estéro-especificidade, selectividade posicional, …)
- actividade óptima em condições suaves de T, pH, P
- poucos ou nenhuns sub-produtos
- ambientalmente convenientes
- possibilidade de catálise em solventes orgânicos
- possibilidade de imobilização
Existem também algumas dificuldades:
- insuficiente estabilidade para aplicações comerciais
- custos de preparação elevados
- frequentemente problemas de inibição
- reutilização nem sempre fácil (→ células (se co-factores), imobilização de enzimas) ….
- concentração baixa de substratos e produtos (→ solventes orgânicos)
- alergenicidade
Como foi referido, embora haja hoje intenso trabalho sobre outros tipos de biocatalisadores, as aplicações industriais envolvem sobretudo enzimas e células. Obviamente os respectivos desempenhos apresentam também vantagens e desvantagens relativas.
::: Início :::
1.4. Biocatálise Vs catálise química
Neste balanço de vantagens e desvantagens da biocatálise face à catálise química, a pergunta lógica que poderá pôr-se é a de saber quando deveremos optar por um processo de catálise química ou por um processo de biocatálise. A resposta não existe porque cada caso é um caso e os factores determinantes são muitos e complexos. Analisando os casos de sucesso comercial não é possível deduzir regras geralmente aplicáveis na decisão por qualquer das vias química ou biocatalítica, a qual terá de ser tomada sempre numa base de competição multifactorial.
Primeiro que tudo tem de haver um biocatalisador da reacção pretendida para que possa haver biocatálise como alternativa; além disso os custos de preparação dos biocatalisadores são elevados; por outro lado, factores de natureza técnico-económica e comercial podem limitar severamente o desenvolvimento de bioprocessos; também factores externos (de ordem legal, de segurança, de orientação preferencial do consumidor, e.g., produtos ditos “naturais”).
Em geral, a adopção de uma via biocatalítica será tomada (sempre numa base de forte competição a priori desfavorável) quando as tecnologias alternativas (e.g., catálise química) falham ou quando as suas propriedades catalíticas, em especial as suas especificidades (regio-selectividades ou estereo-especificidades), permitem melhor (ou até exclusivamente) produzir um novo produto alvo, melhorar processos (por exemplo, ambientalmente mais compatíveis, ou com menos problemas de purificação de produtos secundários) ou melhorar as características de um produto (e.g., produto natural terá melhor aceitação que um produto de síntese química). Assim sendo, a aplicação de biocatalisadores ocorreu sempre que houve possibilidade de tirar vantagem técnica das suas potencialidades, sendo relevantes as aplicações que tirem vantagem da quiralidade dos enzimas para pequenas produções de produtos de elevado valor.
::: Início :::
2. Cinética de Michaelis Menten
2.1 Fundamentos Cinéticos (Reacções em fase aquosa)
Os primeiros estudos da cinética enzimática com base científica foram feitos por Leonor Michaelis e Maud Menten, em 1913, que propuseram pela primeira vez um mecanismo para as reacções catalisadas enzimaticamente. As suas concepções foram baseadas nos factos observáveis quando um substrato sofre uma transformação sob a acção catalítica de um enzima:
- a velocidade aumenta hiperbolicamente com a concentração do substrato, sendo a reacção de ordem zero quando a concentração do substrato é elevada e de 1ª ordem quando a concentração é baixa.
- a velocidade aumenta linearmente com a concentração de enzima, para qualquer valor constante da concentração de substrato.
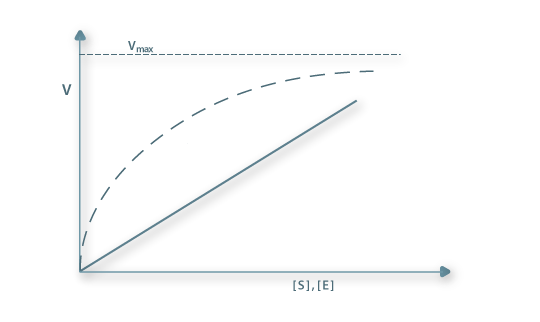
Figura 1 – Efeitos das concentrações de substrato (_ _ _ _ _) e de enzima (______ ) na velovidade das reacções enzimáticas
Baseados nestes factos consideraram que a conversão de um substrato, S,
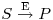 | (1) |
não seria directa mas mediada por um primeiro passo reversível cujo equilíbrio seria
| Error (moslatex): Unable to create dvi file, probably due to incorrect input. | (2) |
estabelecido quasi-instantâneamente quando uma molécula de S se liga ao sítio activo ou centro activo da molécula de enzima, E, com formação de um composto intermédio activo, ES. A decomposição deste complexo no produto, P, com libertação da molécula de enzima seria praticamente irreversível e limitante da velocidade global (i.e., k2 seria muito menor que k-1). Assim, chegaram a uma equação
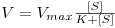 | (3) |
em que
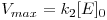 | (4) |
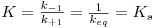 | (5) |
sendo K o inverso da constante de equilíbrio, representando o inverso da afinidade entre enzima e substrato. (KS é a constante de dissociação do substrato).
Em 1925 Briggs e Haldane propuseram uma extensão do tratamento de Michaelis e Menten em que o mecanismo seria idêntico (eq. 2), sujeito, porém, a diferentes condicionalismos: a constante k2 não seria muito menor que k-1, e que após um muito curto período inicial a concentração do composto activo, [ES], seria praticamente constante ao longo do tempo, isto é
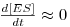 | (6) |
Com esta aproximação ao estado estacionário Briggs e Haldane deduziram uma a lei cinética formalmente idêntica à equação obtida por Michaelis e Menten (ver Caixa 1 )
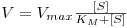 | (7) |
mas onde a constante K é agora
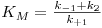 | (8) |
que, curiosamente, ficaria conhecida por Constante de Michaelis-Menten ou, mais vulgarmente, Constante de Michaelis.
A equação 7 traduz os factos observados experimentalmente. A validade da aproximação do estado quasi-estacionário é matematicamente comprovada quando [E]0 é muito inferior a [S]0.
Ora, a velocidade da reacção pode ser descrita de um modo geral por
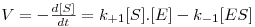 | (9A) |
sendo, simultaneamente,
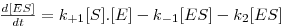 | (9B) |
Este sistema de equações está sujeito às seguintes condições iniciais:
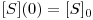 | (10A) |
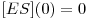 | (10B) |
e a respectiva solução exacta dá-nos os valores de [E], [S], [ES] e [P] em função do tempo, permitindo confirmar que [ES] ≈ constante.
CAIXA 1
Considerando a aproximação do estado quasi-estacionário
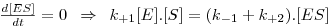
Considerando a lei da conservação das espécies na solução
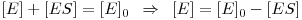
Então
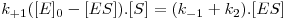
de onde
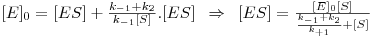
Ora
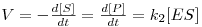
e, portanto,
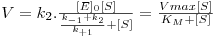
::: Voltar :::
A constante KM é expressa em unidades de concentração e tem um significado tal que quando a concentração do substrato iguala o seu valor a velocidade da reacção é igual a metade de Vmax (i.e., [S]½ = KM => V = ½Vmax).
A decomposição do complexo ES em P e E nem sempre é tão simples e directa, envolvendo, por vezes, múltiplos passos em série cujas constantes são geralmente condensadas num único parâmetro kcat que, na situação mais simples, é justamente a constante k2, (o turnover number – número de moléculas de substrato que por unidade de tempo são convertidas em produto no sítio activo quando o enzima está completamente saturado de substrato).
A relação kcat/KM representa a eficiência do enzima, que se situará entre um limite inferior (velocidade da reacção sob controlo cinético) e um limite superior (velocidade da reacção sob controlo difusional):
- k2 « k-1 ↔ kcat /KM = k2/KS é o limite inferior de eficiência (controlo cinético)
- k2 » k-1 ↔ kcat /KM = k1 é o limite superior de eficiência (controlo difusional)
O valor superior de kcat /KM é, pois, o valor de k1, o qual não pode ser superior à velocidade de colisão entre E e S limitada por difusão. O valor máximo de k1 e, portanto, de kcat /KM, situa-se entre 108 e 109 M-1s-1.
::: Início :::
2.2 Estimativa dos parâmetros cinéticos
Dado que Vmax é um valor assimptótico, os parâmetros cinéticos KM e Vmax determinados directamente por tratamento de dados experimentais com base na equação de Michaelis (eq.7) seriam afectados por indeterminações significativas. Os valores de KM e Vmax podem, porém, estimar-se experimentalmente linearizando a equação de Michaelis.
Determinando as diferentes velocidades correspondentes a diferentes concentrações de substrato, várias formas de linearização da equação de Michaelis podem ser consideradas para tratamento de dados, a saber:
- Equação de Lineweaver-Burk:
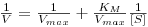 | (11) |
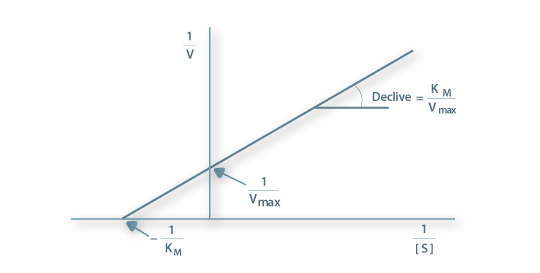
Figura 2 – Representação gráfica da equação de Lineweaver-Burk
Da representação gráfica de 1/V versus 1/[S] obtém-se um recta cujo ordenada na origem é 1/Vmax e cujo declive é KM/Vmax (Fig. 1).
- Equação de Eadie-Hofstee:
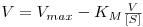 | (12) |
A equação de Eadie-Hofstee permite obter Vmax e KM da representação gráfica de V versus V/[S].
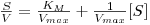 | (13) |
Representando [S]/V versus [S] obtém-se uma recta cujo declive é 1/Vmax e cuja ordenada na origem é KM/Vmax.
Estatisticamente, a equação de Lineweaver-Burk é a que dá piores estimativas daqueles parâmetros em todas as circunstâncias em que não são atribuídos pesos aos pontos experimentais. As estimativas fornecidas pelo método de Hanes são superiores às que são fornecidas pela equação de Eadie-Hoftee quando os erros experimentais que afectam V são pequenos, mas o contrário acontece quando os erros de V são grandes, constantes ou variáveis. A equação de Eadie-Hofstee, por sua vez, tem a vantagem de avisar o investigador sobre os desvios dos dados em relação às relações teóricas na medida em que tende a exagerar esses desvios.
Mais recentemente uma outra forma de linearização da equação de Michaelis, conhecida como “direct linear plot”, permite obter melhores estimativas de KM e de Vmax.
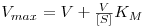 | (14) |
Neste modo de linearização os valores experimentais de V são marcados directamente no eixo das ordenadas e os correspondentes valores de [S] são marcados na parte negativa das abcissas. Unindo cada par destes valores obtêm-se rectas que, se não houvesse qualquer tipo de erro experimental, todas se intersectariam todas num mesmo ponto. Contudo, elas intersectam-se entre si duas a duas, cada intersecção fornece um par de valores (KM, Vmax), e a melhor estimativa de KM e de Vmax é a mediana das distribuições desses pares de valores.
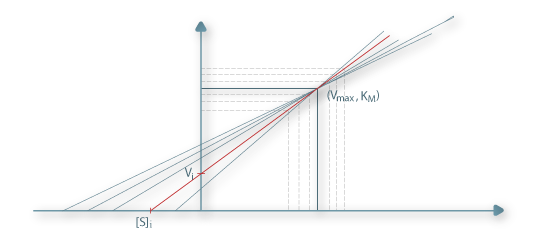
Figura 3 – Determinação dos parâmetros cinéticos segundo o “direct linear plot”
::: Início :::
2.3 Inibição da actividade enzimática
Quando a presença de uma substância, I, na solução provoca a diminuição da velocidade da reacção então I designa-se um Inibidor e a sua acção pode ser reversível ou irreversível. A inibição reversível é caracterizada por um equilíbrio estabelecido muito rapidamente entre enzima e inibidor. Os principais tipos de inibição reversível são a inibição competitiva, a inibição não-competitiva e a inibição incompetitiva (caso muito particular de inibição mista. Estes distintos tipos de inibição reversível podem distinguir-se experimentalmente pelos efeitos do inibidor na cinética da reacção e que se podem analisar recorrendo à equação de Michaelis.
::: Início :::
2.3.1 Inibição pelo substrato
Quando a concentração de substrato é elevada a acção inibidora pode traduzir-se pelas seguintes equações
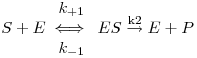
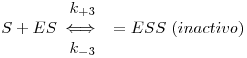
Recorrendo à aproximação de estado quasi-estacionário, a velocidade da reacção é dada pela equação
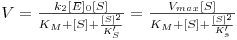 | (15) |
::: Início :::
2.3.2 Inibição competitiva
A inibição competitiva ocorre quando o inibidor compete com o normal substrato para se ligar ao sítio activo catalítico. O esquema das reacções em causa é o seguinte
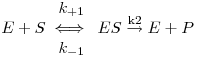
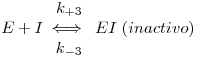
No estado quasi-estacionário pode deduzir-se que a velocidade da reacção é dada por
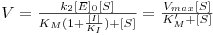 | (16) |
onde
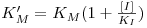
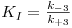
Linearizando a equação 16, obtém-se (deixa-se como exercício a dedução da equação)
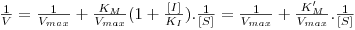 | (17) |
Numa representação de 1/V vs. 1/[S] obtém-se uma recta cuja ordenada na origem é 1/Vmax, isto é, o inibidor não afecta o valor de kcat e, consequentemente, também o valor de Vmax. O valor de KM, por sua vez, é aumentado na presença do inibidor e o declive será tanto maior quanto mais forte for a ligação entre E e I.
::: Início :::
2.3.3 Inibição não-competitiva
Na inibição não competitiva o inibidor liga-se a E ou ES, não no sítio activo do enzima mas num outro sítio não cataliticamente activo. Ao ligar-se a E ou ES forma complexos inactivos, alterando o valor de kcat. O esquema reaccional é como segue:
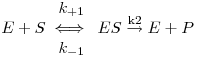
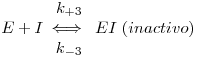
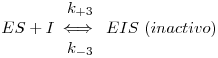
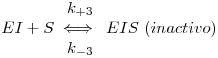
Supondo que I tem idêntica afinidade para E e para ES (mas podem essas afinidades ser diferentes)
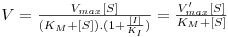 | (18) |
onde
Invertendo os termos da equação 18 obtém-se (deixa-se como exercício a dedução da equação):
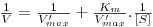 | (19) |
A presença de inibidor não altera o valor de KM mas altera o valor de Vmax.
::: Início :::
2.3.4 Inibição incompetitiva
Na inibição incompetitiva (também designada anticompetitiva), uma designação que se pode aceitar da tradução do termo anglo-saxónico uncompetitive (ambos os termos de significado pouco inteligível), o inibidor não se combina com o enzima livre nem interfere com a ligação entre enzima e substrato; porém, combina-se com o complexo enzima-substrato para formar um complexo ESI inactivo, de acordo com o esquema seguinte
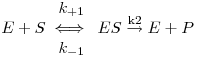
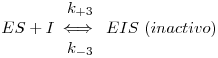
A expressão para a velocidade com a aproximação do estado quasi-estacionário é
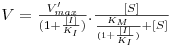 | (20) |
isto é
que, após inversão dos termos, é equivalente a
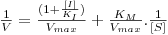 | (21) |
De novo, representando 1/V vs. 1/[S] obtém-se uma recta cujo declive não é alterado quando comparado com o da mesma representação na ausência de inibidor mas cuja ordenada na origem é aumentada do factor (1+[I]/KI) (rectas, portanto, paralelas). A abcissa na origem, por sua vez, é
A identificação destes tipos de inibição pode então fazer-se numa representação gráfica como se mostra na figura seguinte:
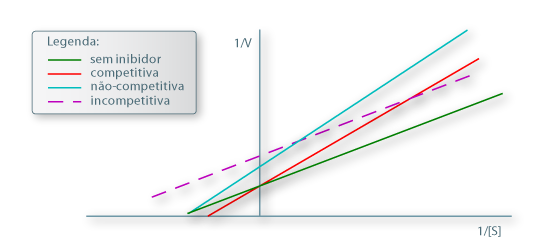
Figura 4 – Diagrama Lineweaver-Burk para comparação dos diferentes tipos de inibição com a ausência de inibidor
::: Início :::
2.4 Mecanismos
A relação íntima que deverá estabelecer-se a nível molecular entre o enzima E e o substrato S e que ao tempo de Michaelis e Menten seria devidamente representada pela analogia entre Chave e Fechadura, proposta por Emile Fisher em 1894. Contudo, esta analogia, que ao tempo era muito sofisticada, pressupunha uma estrutura rígida do enzima e não permitia explicar novos factos como a acção de certos enzimas sobre substratos de elevadas dimensões moleculares sendo inactivos sobre substratos com semelhanças mas de menores dimensões moleculares. Além disso, não permitia explicar a razão porque certos enzimas podem catalisar a conversão não só dos respectivos substratos naturais mas também de outros compostos com diferentes características estruturais.
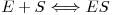
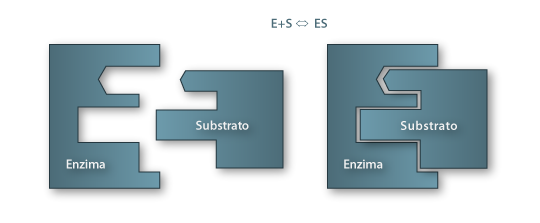
Figura 5 – Representação esquemática do mecanismo “Chave-Fechadura”
Um outro modelo consiste num ajuste induzido na conformação do sítio activo (Induced-Fit), desenvolvido por Koshland Jr. (1968). Este modelo considera, por oposição, estruturas enzimáticas relativamente flexíveis e que durante a formação do complexo ES a conformação do enzima altera-se sob a influência da estrutura do substrato de modo a englobá-lo. Este modelo explica a razão porque em muitos casos são necessárias certas características estruturais no substrato para que ocorra reacção. Um exemplo típico é a acção das lipases que podem catalisar transformações em muitos substratos que nada têm a ver com os triglicéridos, seus substratos naturais.
Figura 6 – Representação esquemática do mecanismo “Ajuste induzido” (Induced-fit)
Numa tentativa de explicar porque razão certos substratos de pequenas dimensões são convertidos mais lentamente do que os seus análogos de maiores dimensões, foi dsenvolvida mais recentemente por M.J.S. Dewar (1986) a teoria da dessolvatação segundo a qual o substrato, entrando no sítio activo do enzima, desloca todas as moléculas de água de solvatação do sítio activo: os substratos mais pequenos não seriam tão eficazes a remover todas as moléculas de água do sítio activo. Como extensão para os casos em que a remoção da água envolvente do substrato é energeticamente desfavorável, foi desenvolvida a teoria da substituição da solvatação segundo a qual a água solvente seria substituída por outro ambiente fornecido pelo sítio activo do enzima, como é o caso de muitas vezes os substratos hidrófobos terem a água de solvatação substituída por sítios hidrófobos do enzima. Em qualquer destas situações seria necessário uma ligação forte e rígida entre enzima e substrato.
A regra da acoplagem tripontual (3-point attachment rule) proposta por Ogston é geralmente usada para explicar a enantio-selectividade em que o substrato tem de ser firmemente ligado num espaço tridimensional.
::: Início :::
2.5 Bases cinéticas da selectividade
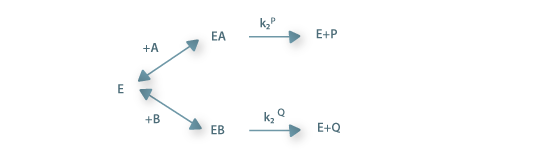
Uma das características mais importantes dos enzimas é a sua selectividade de que resulta que em substratos quirais a acção catalítica se exerce preferencialmente, por vezes exclusivamente, sobre um dos enantiómeros. Entre a ligação do substrato ao enzima e a libertação do enzima e do produto formado ocorre uma série de eventos que no mínimo estão traduzidos na seguinte equação
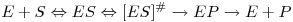 | (22) |
No mínimo o complexo ES tem de ser formado, passando depois por um estado de transição excitado [ES]# dando origem depois a um complexo enzima-produto, EP, que finalmente se dissocia com formação do produto e libertação da molécula de enzima.
O poder catalítico dos enzimas deriva da estabilização do estado de transição da reacção pelo enzima - o catalisador liga-se mais fortemente ao estado de transição do que ao estado fundamental do substrato. As estéreo-selectividades têm origem nas diferenças de energia dos diferentes complexos enzima-estado-de-transição [ES]#. Assim, considerando dois enantiómeros A e B (ou duas orientações enantioméricas) competindo para o mesmo sítio activo do enzima formam-se dois complexos ES diastereoméricos EA e EB cujos estados de transição [EA]# e [EB]# possuem diferentes energias livres, ΔG.
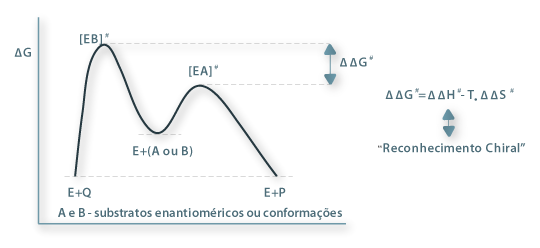
Figura 7 – Esquematização da bases de reconhecimento quiral
A diferença ΔΔG#, responsável, pois, por um "reconhecimento quiral" (chiral recognition), é uma medida da selectividade, EAB, da reacção (ou do enzima) que, por sua vez, depende da velocidades individuais VA e VB de transformação dos substratos A e B e determina a pureza óptica do produto.
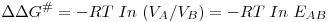 | (23) |
onde
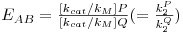 | (24) |
A pureza óptica do produto P será
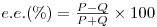 | (25) |
A entalpia de activação ΔH# é geralmente dominada por variações nas ligações quando o substrato é transformado no produto, resultante da acção de forças dipolares e estéreas, enquanto a entropia inclui o balanço da energia necessária para a orientação dos reagentes ou que resulta de variações na flexibilidade conformacional durante o ajuste induzido (induced fit) e vários efeitos de concentração e solvatação.
Um bom exemplo é o do mecanismo de acção das hidrolases serínicas cuja tríade catalítica do sítio activo é constituído por resíduos de Ser-Asp-His; o arranjo espacial destes resíduos é de modo a diminuir o pK do grupo hidroxi da serina e assim permitir um ataque nucleofílico ao grupo carbonilo de um substrato R1-CO-OR2, com formação de um "intermediário acil-enzima" e libertação do grupo R2-OH. Um nucleófilo presente no meio pode, então, atacar esse "intermediário acil-enzima" e, em conformidade, teremos uma hidrólise se o nucleófilo é a água, ou um conjunto de importantes e diferentes reacções de síntese como interesterificações (transferência de grupos acilo), quando o nucleófilo é outro álcool com formação de um éster, aminólise de ésteres, quando o nucleófilo é uma amina com formação de uma amida, peracidólise quando o nucleófilo é o peróxido de hidrogénio, ou ainda hidrazinólise.
Destas reacções as mais importantes são as de síntese de péptidos. A síntese de péptidos (que podem ter uma enorme diversidade de aplicações: edulcorantes, toxinas, antibióticos, agentes quimiotáticos, factores de crescimento, estimulantes ou inibidores de factores de crescimento, imunogénicos para a produção de anti-soros específicos, etc.) pode ser realizada por via química ou enzimática com prós e contras relativos. Enzimaticamente a síntese pode ser conduzida por três vias diferentes: inversão da hidrólise, transpeptidação e aminólise de ésteres. As duas primeiras vias são sob controlo termodinâmico, em vista da reversibilidade das reacções. A terceira via é uma reacção de tipo irreversível, rápida, em que dois nucleófilos competem (água e uma amina) para o interdiário acil-enzima, feita sob controlo cinético em ambiente geralmente de baixo conteúdo de água. Esta é uma situação idêntica à de glicosilação que pode igualmente ocorrer sob controlo termodinâmico ou cinético, sendo esta última via de muito maior rendimento.
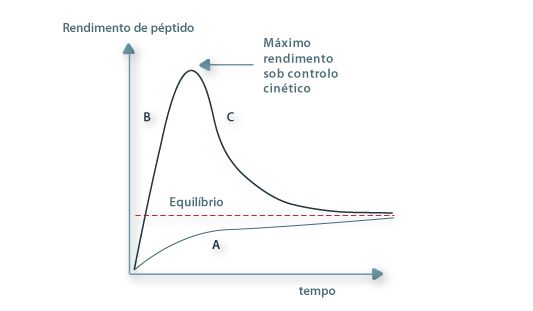
Figura 8 – Síntese de péptido sob controlo termodinâmico (A) e controlo cinético (B).
::: Início :::
3. Imobilização
A Imobilização de células ou enzimas, que permite a sua reutilização, é um conceito largo que inclui a fixação do biocatalisador em matrizes sólidas ou a sua confinação em espaços delimitados por membranas semi-permeáveis. Neste último caso os biocatalisadores estão livres no espaço confinado e do ponto de vista catalítico há que considerar não só as resistências cinéticas mas também as resistências adicionais à transferência de massa na zona da membrana (N.B. – com custos mais elevados e a estabilidade também é mais reduzida).
Quando se pretende imobilizar um biocatalisador os objectivos a atingir são genericamente os seguintes:
- recuperação e reutilazação
- mais fácil recuperação dos produtos
- estabilização de substratos
- estabilização de enzimas
- t1/2 > 6 meses
- produtividade elevada (centenas de kg de produto por kg de biocatalisador)
- boa tolerância a variações na força iónica (0,01 - 1), pH e temperaturas
- resistência a ataque microbiano (geralmente o processo não decorre em condições de sterilidade)
- custos de imobilização reduzidos (1-3% do custo do produto final típico na penicilina)
Contudo, há também algumas dificuldades nem sempre fáceis de contornar:
- o substrato tem de estar solubilizado e altamente purificado
- limitações difusionais que conduzem a um menor rendimento do produto
O biocatalisador a imobilizar pode ser enzima ou células com as seguintes vantagens / desvantagens relativas das células:
- Vantagens da imobilização de células relativamente à imobilização de enzimas:
- maior estabilidade operacional
- regeneração endógena de co-factores
- possibilidade de reacções multienzimáticas
- elimina os custos de extracção e purificação de enzimas
- Desvantagens da imobilização de células relativamente à imobilização de enzimas:
- contaminação bacteriana
- reacções colaterais
- resistências difusionais de substratos de peso molecular mais elevado
- reduzida solubilidade de oxigénio nas matrizes
- transporte de gases impedido nas matrizes
- mais fácil alteração do microambiente (e.g., pH) se a difusão é limitante
- menor actividade específica
Os métodos de imobilização resumem-se a seguir:
- Crosslinking com glutaraldeído (e.g., Bacillus coagulans glucose isomerase na produção de Sweetzyme®): conduzindo a custos reduzidos, actividade expressa elevada, resistência mecânica das partículas (300-1000 μm) suficiente p/ colunas de 5 m de altura (típico), t1/2 mais elevado que pelos outros métodos.
- Adsorção
- fraca (pontes de hidrogénio, interacção hidrofóbica)
- forte (ligação iónica)
- Aprisionamento (entrapment) em Gel
- Ligação covalente
São diversos os materiais seleccionáveis para constituir as matrizes de imobilização segundo os diferentes métodos, indo desde a simples celulose até materiais mais elaborados de diversas naturezas como polímeros orgânicos naturais ou sintéticos, modificados ou não, materiais cerâmicos, vidro poroso de poro controlado, zeólitos, etc.
Tabela 1 - Materiais para imobilização de Biocatalisadores
| MÉTODOS | ADSORVENTES |
| Adsorção física | Carvão activado, sílica gel, alumina, amido, vidro
tanino-aminohexil celulose, Concanavalina-A Sepharose |
| Adsorção iónica | Permutadores catiónicos (CM-Celulose, Amberlite CG-50, Dowex-50) Permutadores aniónicos (DEAE-celulose, DEAE-Sephadex, Amberlite IR-45
poliaminopoliestireno) |
| Aprisionamento | Poliacrilamida (Gel, esferas), alginato, Nylon, lipossomas |
| Covalente | Celulose, CM-celulose, Agarose (e.g., Sepharose), Dextrano (e.g., Sephadex), Polyacrylamida (e.g., Bio-Gel, Enzacryl), poliestireno, poliamidas (e.g., nylon), copolímeros de anidrido maleico, vidro poroso, óxidos metálicos (e.g., Fe, Ni), Cerâmicos (e.g., TiO2/MgO, SiO2/Al2O3, SiO2/ZeO2) |
Há obviamente critérios de selecção destes materiais, que vão desde os custos dos materiais até requisitos especiais de utilização, passando pela complexidade da química de imobilização quando se trata sobretudo de ligações covalentes.
Tabela 2 - Factores a considerar na selecção de matrizes de imobilização
| FACTOR | Custo da matriz | Esferas de dextrano ou vidro de poro controlado são muito mais caros que cerâmicas ou celulose |
| Inércia química | Matrizes de base sílica solúveis a pH>8; degradação enzimática de matrizes de base celulose ou dextrano |
Propriedades
físicas | Porosidade, dimensões dos poros, forma, resistência mecânica à pressão e ao atrito, hidrofobicidade... |
Química de
imobilização | Adsorção: é rápida e fácil e muito menos desnaturante;
Ligação covalente: é laboriosa, cara e inactivante de enzimas instáveis |
| Estabilidade da preparação | Perda de enzimas imobilizados fisicamente relativamente à imobilização covalente |
| Requisitos especiais do processo | Matrizes compressíveis são inadequadas para reactores de tipo pistão; matrizes com magnetite são úteis para a recuperação em reactores CSTR |
A química de ligação é particularmente importante havendo que escolher a matriz em função da funcionalidade química (natureza e densidade da função química pretendida). Normalmente a imobilização envolve dois passos:
1. Activação da matriz, inserindo eventualmente um braço espaçador;
2. Ligação do enzima
O vidro poroso e as sílicas em geral são suportes correntes cuja activação é feita por silanização dos grupos hidroxilo usando aminoalquiletoxi- ou aminoalquil-cloro-silanos.
Os suportes baseados em polímeros naturais do tipo polissacárido são boas alternativas pois têm em geral um tamanho de poro bem definido. A activação dos grupos hidróxido adjacentes faz-se com bromonitrilo CNBr (brometo de cianogénio) -muito tóxico- para formar imidocarbonatos reactivos a que se ligam os grupos amina de enzima.
Tabela 3 – Alguns dos aspectos mais comuns da química de imobilização
| GRUPO DA MATRIZ | EXEMPLOS DE MATRIZ | REAGENTE ACTIVADOR | GRUPO DO ENZIMA |
| Hidroxilo | Dextranos, Celuloses, agarose | Brometo de cianogéneo | Amina |
| Carboxilato | CM-celulose, copolímeros de acrilamida/ácido acrílico | Carbodiimidas | Amina |
| Amina | Cerâmica modificada | Glutaraldeído; Cloreto de p-nitrobenzilo/
ditionite/nitrito de sódio, ácido | Amina
Tyr-hidroxilo |
| Aldeído | Polímeros de aldeídos | Reage directamente via base de Schiff | Amina e outros |
| Imidoéster | Nylon O-alquilado | Reage directamente | Amina |
| Arildiazónio | Cerâmica modificada
Polissacáridos | Reage directamente | Tyr-hidroxilo, His-imidizole, Amina |
| Tiol | Polissacáriodos modificados | Reage directamente | Cys-tiol |
Co-polímeros sintéticos (e.g., baseados em PVAc –polivivil acetato) podem ser parcialmente hidrolisados para libertar funções hidroxilo que são depois activados com epicloridrina (e.g., VA-Epoxy, Biosynth® ou Eupergit®): os grupos epoxi formados reagem directamente alquilando os grupos amina do enzima em condições suaves. Resinas com grupos carboxilo podem ser activadas com cloreto de tionilo (SOCl2) transformando os grupos carboxilo em cloretos de ácido que então formam amidas estáveis com os grupos amina do enzima.
::: Início :::
3.1 Transferência de massa
O design de bio-reactores com biocatalisadores imobilizados requer uma análise detalhada das respectivas propriedades cinéticas. A expressão do poder catalítico depende da conjugação das propriedades cinéticas intrínsecas do biocatalisador imobilizado e as resistências ao transporte do substrato no percurso para o sítio catalítico (e do produto no percurso inverso).
As propriedades cinéticas do enzima são alteradas com o processo de imobilização devido às modificações conformacionais que a moléculas de enzima sofre ao nível do sítio activo. Mas a sua expressão depende da velocidade com o substrato, indo da solução, atinge o sítio activo no interior da partícula de catalisador. Nesse percurso geram-se gradientes de concentração do substrato cuja intensidade depende dos mecanismos de transferência. No exterior da partícula o processo de transferência pode ser por difusão molecular se ao solução não estiver agitada ou convectivo se houver agitação; ao atingir a superfície da partícula a substrato terá ainda de fazer um percurso no interior que poderá também ocorrer por mecanismos difusionais ou convectivos, dependendo da natureza e estrutura do suporte inerte.
A análise destes processos é, por vezes, muito complexa, a requerer o imprescindível contributo da engenharia da reacção química, e será abordada a seguir.
::: Início :::
3.1.1 Efeitos de Resistência Externa à Transferência de Massa
Em suportes não porosos o enzima está imobilizado à superfície e quer o substrato quer o produto estão sujeitos apenas a resistências externas à transferência de massa através do filem de fluido em redor da partícula. O fluxo de substrato (número de moles transferidos por unidade de área e unidade de tempo) pode então ser expresso em função de um coeficiente de transferência de massa, kL, e de uma diferença de concentrações
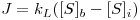 | (26) |
O substrato é então consumido à superfície da partícula à taxa de
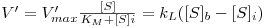 | (27) |
equivalente a
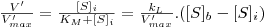 | (28) |
e sucessivamente
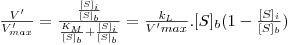 | (29A) |
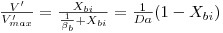 | (29B) |
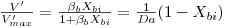 | (29C) |
onde o índice “i” significa “na interface”, o índice “b” significa “no toda da solução”, e ainda
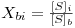 | (30) |
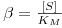 | (31) |
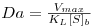 | (32) |
Da é o “Número de Damköhler” cujo significado físico é o de uma “razão entre a velocidade máxima da reacção e a velocidade máxima de transferência de massa”.
A velocidade da reacção de consumo do substrato seria maximizada se não houvesse resistências à transferência de massa, isto é, se a concentração do substrato fosse
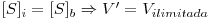 .
.
Então, das equações 29, obtém-se
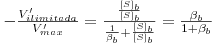 | (33) |
(Note-se que V’ilimitada não é Vmax e se [S]b ~ KM então V’ilimitada é muito inferior a Vmax).
Os efeitos da transferência de massa externa podem ser expressos quantitativamente por um Factor de efectividade externo, ηee, que traduz a razão entre a velocidade observada actual e a velocidade que se observaria na ausência desses efeitos:
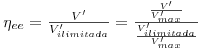 | (34) |
Atendendo às equações 29C e 33 tem-se
e finalmente
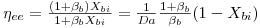 | (35) |
Resolvendo simultaneamente as equações 29C e 35, para eliminação de Xbi, obter-se-ia uma relação
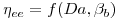 | (36) |
que pode ser expressa graficamente com Βb como parâmetro.
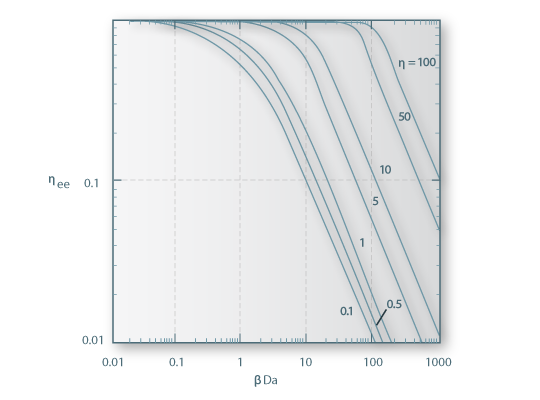
Figura 9 – Relação entre ηee e o Número de Damköhler
Uma dificuldade no uso deste gráfico reside no facto de se não conhecer os valores ou estimativas dos parâmetros cinéticos intrínsecos (em particular V'max) necessários para o cálculo de Da e de βb. Conhecendo, no entanto, o valor aparente de V'max (ap) pode definir-se um “Número de Damköhler observável”, 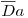 , tal que
, tal que
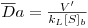 | (37) |
Das equações 33 e 34 vem
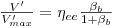 | (38) |
Então
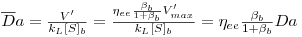 | (39) |
Resolvendo simultaneamente as equações 36 e 39, obter-se-á
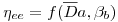 | (40) |
cuja representação gráfica se esquematiza na Figura
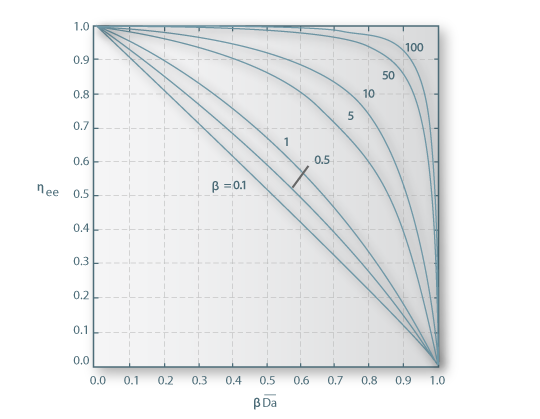
Figura 10 – Relação entre ηee e o Número de Damköhler observado
A solução da equação 27 pode ser obtida graficamente como se mostra na figura
Figura 11 - Solução gráfica para a equação 27: (A) Curva da cinética da reacção, (B) Velocidade de transferência de massa
::: Início :::
3.1.2 Efeitos de Resistência INterna à Transferência de Massa
Os enzimas ou células são tipicamente imobilizados nas superfícies internas de suportes porosos ou aprisionados em matrizes através dos quais o substrato tem de difundir-se. Estimar a velocidade observada do desaparecimento do substrato requer então o conhecimento do perfil de concentrações de substrato no interior da partícula que, por sua vez, depende da velocidade de difusão efectiva.
A transferência de massa interna ocorre em simultaneidade com a reacção (ao contrário da transferência de massa externa) e os dois processos terão de ser traduzidos no balanço de massas no interior dos poros. Em coordenadas esféricas (sendo r a posição radial) e em regime estacionário:
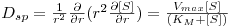 | (41) |
ou
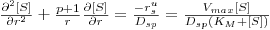 | (42) |
onde p é um factor geométrico (= +1 para esferas; 0 para cilindros; -1 para membranas planares). [Vmax tem a unidades mol/(volume.s)]
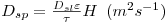 | (43) |
ε é a porosidade da partícula e τ ?é a tortuosidade τ>1, por definição). H é um factor correctivo que tem em conta as interacções entre o substrato e as paredes dos poros e também o atrito das paredes sobre o soluto:
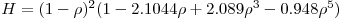 | (44) |
Adimensionalisando o balanço de massa ao substrato:
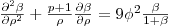 | (45) |
com ρ=r/R e, no caso de partículas esféricas,
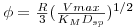 | (46) |
sujeito às condições fronteiras:
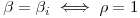 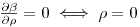
| (47) |
O termo adimensional Φ é o módulo de Thiele e é a razão entre a velocidade intrínseca da reacção química na ausência de resistências à transferência de massa e a velocidade de difusão mo interior da partícula. O significado físico de Φ2 é análogo ao do Número de Damköhler. Genericamente
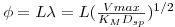
onde L é um comprimento característico igual à razão do volume da partícula e da área da superfície para a difusão, i.e., L=R/3 para esferas, R/2 para cilindros e Espessura/2 para geometria plana.
A solução desta equação sujeita a estas condições fronteiras dá
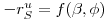 | (48) |
Do mesmo modo pode-se exprimir os mesmos resultados na forma gráfica de um "factor de efectividade interno" em função do módulo de Thiele, o qual é genericamente para partículas esféricas
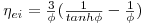 | (49) |
e que toma os valores limites (Figura 12)
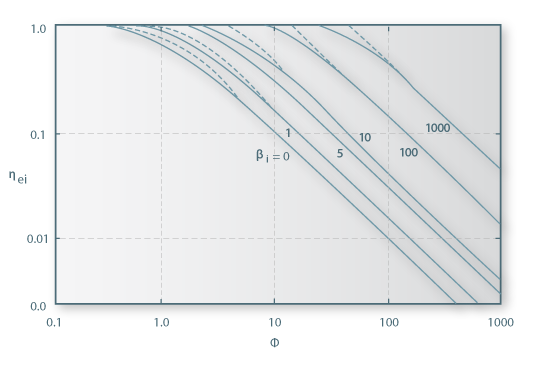
Figura 12 – O Factor de efectividade interno ηei como função do módulo de Thiele Φ com βi como parâmetro
::: Início :::
3.1.3 Efeitos Simultâneos das Resistências Externa e Interna à Transferência de Massa
Quando se observam regimes difusionais externos e internos o coeficiente de efectividade é combinado e teremos
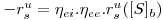 | (50) |
ou
com
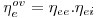 | (51) |
::: Início :::








