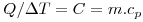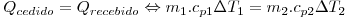Energia, Calor e Temperatura
Equilíbrio Térmico
Escalas de Temperatura
Conforme exposto nas secções anteriores, o Calor (Q) é, pois, a energia térmica transferida entre dois sistemas (sejam eles gases, líquidos ou sólidos) devido a uma diferença de temperatura existente entre eles, enquanto a Temperatura é uma medida da agitação média das moléculas e seus constituintes. O calor não é nenhuma entidade, não possui massa, nem é visível. Ocorre transferência de calor entre partículas mais energéticas para outras menos energéticas mas não faz sentido dizer que uma partícula tem mais calor que outra. O calor é, portanto, uma energia em movimento. A unidade do Sistema Internacional (SI) para o calor é o joule (J), a mesma do trabalho, ou da energia total – ver eq. 1. A velocidade com que a energia é transferida, ou seja, a energia transferida por unidade de tempo, exprime-se em watt (W) que é equivalente a J.s-1. Neste portal, essa velocidade de transferência de calor é traduzida por 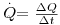 , embora a palavra “Potência” esteja também associada a uma energia por unidade de tempo. Por exemplo, uma placa eléctrica com a potência de 1500 W, fornece a energia de 1500 J em cada segundo.
, embora a palavra “Potência” esteja também associada a uma energia por unidade de tempo. Por exemplo, uma placa eléctrica com a potência de 1500 W, fornece a energia de 1500 J em cada segundo.
Equilíbrio Térmico
A diferença de temperatura fornece a driving-force para a transferência de calor, por exemplo, entre dois corpos postos em contacto. O corpo mais frio aquece (a sua temperatura aumenta) e o corpo mais quente arrefece (a sua temperatura diminui). A 2ª Lei da Termodinâmica permite demonstrar que o calor só pode ser transferido espontaneamente do corpo mais quente para o corpo mais frio. O equilíbrio térmico estabelece-se entre os dois corpos quando as suas temperaturas atingem o mesmo valor. Ocorrerá fluxo (ou transferência) de calor até que a diferença de temperatura seja nula. Aliás, o conceito de temperatura e da sua medição, é baseado no princípio Zero da Termodinâmica que estabelece que quando dois corpos estão em equilíbrio térmico com um terceiro, então eles estão em equilíbrio térmico entre si. A relação entre a quantidade de calor transferida para um corpo (Q), e a consequente alteração na sua temperatura (ΔT) depende da capacidade térmica do corpo (C), a qual é função da massa do mesmo (m) e de uma propriedade termodinâmica do corpo denominada calor específico (cP):
| (3) |
Quanto maior for a capacidade térmica, mais energia é necessária para provocar uma determinada variação de temperatura e esta variação será tanto maior quanto maior for a energia térmica transferida. Por isso, mesmo no Verão, a temperatura da água do mar mantém-se devido à sua grande capacidade térmica. A definição de caloria (cal) está associada exactamente à energia necessária para elevar de 1ºC, 1 g de água, tomando o seu calor específico o valor 1 (cal.g-1.ºC-1). (Na realidade, o calor específico de uma substância não é constante, variando com a temperatura.) Assim, embora Calor e Temperatura não sejam a mesma coisa, o calor específico permite relacionar os dois na mesma fórmula matemática. O cálculo da temperatura no equilíbrio térmico pode ser efectuado a partir da igualdade entre o calor cedido por um corpo e o recebido por outro
| (4) |
Por exemplo, quando se mistura 1 kg de água, inicialmente a 10ºC, com 2 kg de água, inicialmente a 25ºC, a variação de temperatura verificada na água mais fria será cerca do dobro da variação de temperatura que a água mais quente registará. Assim, obter-se-á 3 kg de água com uma temperatura próxima de 20ºC (supondo que o calor específico não varia com a temperatura! - o que é uma aproximação aceitável para os cálculos correntes em Engª Química).
Escalas de Temperatura
Para medir a temperatura de um corpo recorre-se frequentemente a um termómetro, o qual deve possuir uma capacidade baixa, para não alterar o equilíbrio térmico do corpo, e ter uma propriedade que varie regularmente com a temperatura. Além disso, é necessário estabelecer escalas termométricas, normalmente a partir de dois pontos fixos – o ponto de fusão do gelo e o ponto de ebulição normal da água (a 1 atm). O físico e astrónomo Celsius (no início do séc. XVIII) atribuiu ao ponto de fusão do gelo o valor zero e ao ponto de ebulição da água o valor cem. O intervalo entre os dois pontos fixos foi dividido em cem partes iguais, correspondendo a cada uma um grau Celsius, 1ºC. Por isso se diz que a escala Celsius é uma escala centígrada dando por vezes origem a incorrecções como “Hoje estão 30 graus centígrados!”, em vez de “30 graus Celsius”. Há outras escalas de temperatura que atribuem aos mesmos pontos fixos valores diferentes como se mostra na Tabela 1. Nas escalas Fahrenheit (F) e Rankine(R), o intervalo entre os dois pontos fixos foi dividido em 180 partes iguais, correspondendo a 1 ºR=1 ºF mas equivalente a 1,8ºC (ou 1,8 K). As escalas Kelvin (K) e Rankine são escalas absolutas, sendo usadas para as unidades da temperatura absoluta, respectivamente nos sistemas SI e Inglês de Engenharia (BES).
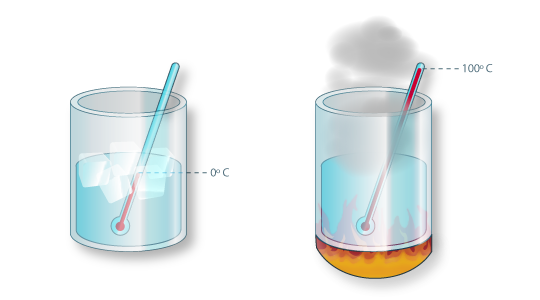
Figura 09: Ponto de fusão do gelo e ponto de ebulição da água na escala Celsius (à pressão atmosférica normal).
Tabela 1 – Escalas de temperatura.
Escala | Celsius, ºC | Kelvin, K | Fahrenheit, ºF | Rankine, ºR |
| Ponto de fusão do gelo a 1 atm | 0 | 273.15 | 32 | 491.67 |
| Ponto de ebulição da água a 1 atm | 100 | 373.15 | 212 | 671.67 |
| Zero absoluto | -273.15 | 0 | -459.67 | 0 |
| Nº de divisões da escala | 100 | 100 | 180 | 180 |
| Variação de temperatura, ΔºC | 1 | 1 | 1.8 | 1.8 |
| Conversão para Celsius | T(ºC) | T(K)-273.15 | (T(ºF)-32)/1.8 | (T(ºR)-491.67)/1.8 |
Bibliografia
As referências bibliográficas e a bibliografia recomendada encontram-se no final da secção de Caso de Estudo.