Objectivos
Regra de Maxwell
Equações da pressão de vapor na forma reduzida
Referências
Objectivos
1 - Determinação de valores pressão, volume e temperatura (PVT) de substâncias puras utilizando equações de estado cúbicas no volume molar da família de van der Waals. Cálculo da pressão de vapor utilizando a regra de Maxwell .
2 - Determinação da pressão de vapor através de equações reduzidas desta propriedade do tipo ln (Pσ,x) = F (Tr, parâmetros) onde Pσ,x é a pressão de vapor reduzida (Pσ =/Pc) e Tr é a temperatura reduzida (Tr=T/Tc).
::: Início :::
1- Regra de Maxwell
O applet java a seguir serve para testar/aplicar alguns conhecimentos adquiridos sobre as equações de estado como sejam: regra de Maxwell, estados estáveis e metasestáveis e desempenho de diferentes equações de estado no cálculo PVT de substâncias puras incluindo a pressão de vapor.
Sobre a utilização do applet deve considerar-se o seguinte:
- O arranque é feito com o Argon e com a equação de VDW. No arranque é necessário fazer (novamente) a selecção de uma equação de estado apesar de a selecção estar por defeito na equação de VDW.
- O significado das variáveis é : Tc (temperatura crítica em kelvin), Pc(pressão crítica em bar), w (factor acêntrico de Pitzer) T (temperatura teste em kelvin), Psel(pressão teste em bar), Vmin (limite mínimo do volume molar no diagrama em cm3/mol) Vmax (limite máximo para o volume molar).
- Na caixa de resultados inferior encontram-se calculadas algumas quantidades de interesse: a (parâmetro atractivo); b (co-volume), PMN e VMN (coordenadas pressão e volume do mímimo da isotérmica), PMA, VMA (coordenadas P e Vm no máximo da curva). Vm(liq), Vm(int) e Vm(gas) são as raízes para um valor de Psel na região de equilíbrio L+G. Vm(int) não tem significado como se discutiu.
- O conteúdo das caixas laterais percebe-se sem explicações.
Applet de Java
Exercícios propostos
1- Determinar a pressão de vapor e o volume molar das fases líquida e gasosa em equilíbrio para o metano à temperatura de 120 K utilizando as equações de VDW, Redich e Kwong, de Soave e de Peng e Robinson. Comparar os valores obtidos com valores da literatura (NIST).
DADOS: Tc = 190.567 K , Pc = 45.95 bar, w = 0.012.
2 - Construir o diagrama PVT do argon utilizando a equação de Soave.
DADOS: Tc = 150.86 K, Pc = 48.98 bar , w = 0.
3 - Construir o diagrama PVT da água utilizando a equação de Peng e Robinson. Compare com os valores da literatura (NIST) e comente os resultados obtidos.
DADOS: Tc = 647.14, Pc = 220.64 bar , w = 0.344.
4 - Coloque a sua imaginação a funcionar ...
Outra ferramenta interessante para o cálculo do equilíbrio VLE foi desenvolvido por P.J. Barrie [1]. O modelo desenvolvido baseia-se na igualdade das fugacidades, e utiliza as equações de van der Waals, de Redlich-kwong, de Soave e a de Peng e Robinson. Pode utilizar-se qualquer substância desde que se disponha das cordenadas do ponto crítico (Tc, Pc) e do factor acêntrico de Pitzer. Esta informação está no entanto já armazenada no programa para 16 substâncias. É possível obter informação de várias propriedades termodinâmicas das fases como sejam volumes molares, factores de compressibilidade, coeficientes de fugacidade, entalpia e entropia.
::: Início :::
2- Equações da pressão de vapor na forma reduzida
O applet java a seguir serve para calcular a pressão de vapor das substâncias puras com algumas das equações na forma reduzida, hoje em dias mais utilizadas para o efeito.
Na caixa a seguir dão-se as indicações sobre a inserção apropriada das propriedades fundamentais necessárias ao funcionamento da applet java. Chama-se a atenção para a linha (ace=0.0,0.0,0.0,0.0) onde a primeira das quatro quantidades é o factor acêntrico (considerado à partida =0.0 mas que terá de ser modificado conforme a substância testada) e a segunda quantidade é o peso molecular da substância (também considerado =0.0 mas o valor terá de ser inserido para a substância testada). Os outros "0.0" não sofrem alteração (nunca). Chama-se ainda a atenção para a zona onde se inserem os valores T,P experimentais (ou tomados como referência). Aqui convém considerar como último par as coordenadas do ponto crítico (Tc, Pc).
Instruções para utilização da applet.
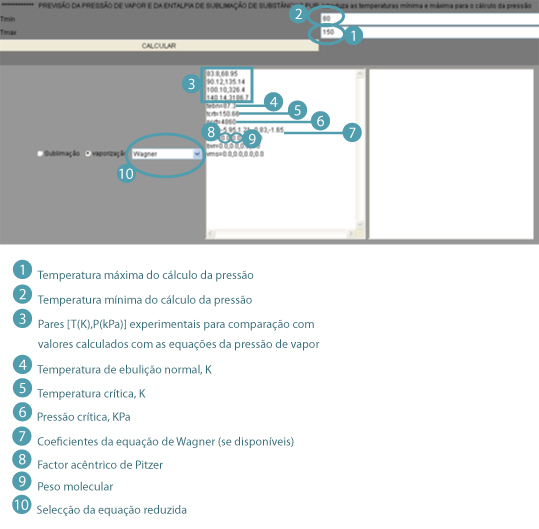
Applet de Java
Exercícios propostos
a) Calcular a pressão de vapor, de substâncias puras não polares, polares ou associadas pelos métodos de (i) Wrede, (ii) Riedel, e de (iii) Gomez, Nieto e Thodos (GNT) em função da temperatura, entre o ponto triplo e o ponto crítico.
b) Comparar os valores calculados com valores de referência (por exemplo retirados das tabelas do NIST ) e avaliar os desvios médios percentuais.
Sugestão para as substâncias puras: (i) gases raros Ar, Kr e Xe; (ii) (i) componentes do gás natural (metano, etano, azoto, propano), N-hexano, dióxido de enxofre e metanol; (iii) àgua, acetato de etilo.
::: Início :::
Referências
- P. J. Barrie, "JavaScript programs to calculate thermodynamic properties using cubic equations of state", Journal of Chemical Education, 82, 958-959 (2005)
::: Início :::