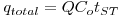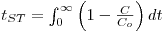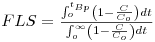1 - Introdução
2 – Equipamento. Adsorventes e resinas permutadoras de iões mais comuns
3 – Equilíbrio de adsorção e de permuta de iões
4 – Cinética de adsorção e operação em leito fixo
Bibliografia
1 - Introdução
A adsorção e permuta iónica são processos de separação baseados na velocidade de transferência de massa, na presença ou não de reacção química, implicando o contacto íntimo entre duas fases (sólido-líquido ou sólido-gás) entre as quais os constituintes se distribuem indiferentemente. O objectivo destas operações pode ser de purificação de correntes (tratamento de efluentes líquidos ou gasosos) ou de separação de componentes de uma mistura (análises cromatográficas).
A adsorção (física) é um fenómeno superficial, em que as moléculas da fase fluida são reversivelmente retidas na superfície de um sólido (adsorvente) por forças de Van der Waals, formando uma camada (monocamada) ou multicamadas de moléculas. Uma vez que a adsorção é um fenómeno de superfície, é importante que os adsorventes proporcionem uma grande área superficial externa e interna associada à sua estrutura porosa. A capacidade de adsorção depende, portanto, do tipo e tamanho dos poros, bem como da sua distribuição, e da natureza da superfície do adsorvente. Segundo a IUPAC (1982), os poros num adsorvente são classificados em função do diâmetro como (ver Figura 1),
- Macroporos: Φ > 50 nm
- Mesoporos: 2 < Φ < 50 nm
- Microporos: Φ < 2 nm
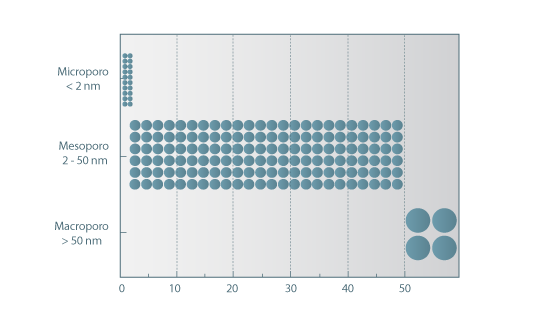
Figura 1 – Classificação do tamanho do poro de acordo com a IUPAC - União Internacional de Química Pura e Aplicada.
A permuta iónica consiste numa troca estequiométrica de catiões ou aniões duma fase líquida por catiões ou aniões de uma resina permutadora de iões. Na Figura 2 está representado um esquema da estrutura de uma resina de permuta iónica constituída por uma matriz polimérica constituída por estireno reticulado com divinilbenzeno (DVB) e um grupo funcional do tipo ácido (resina catiónica). As resinas de permuta iónica podem ser usadas em várias aplicações industriais, tais como, amaciamento de águas, aplicações hidrometalúrgicas e separações de produtos biológicos. Por exemplo, na desmineralização da água, contacta-se água dura com uma resina catiónica na forma H+ e os iões responsáveis pela dureza podem ser permutados:
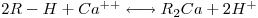 | (1) |
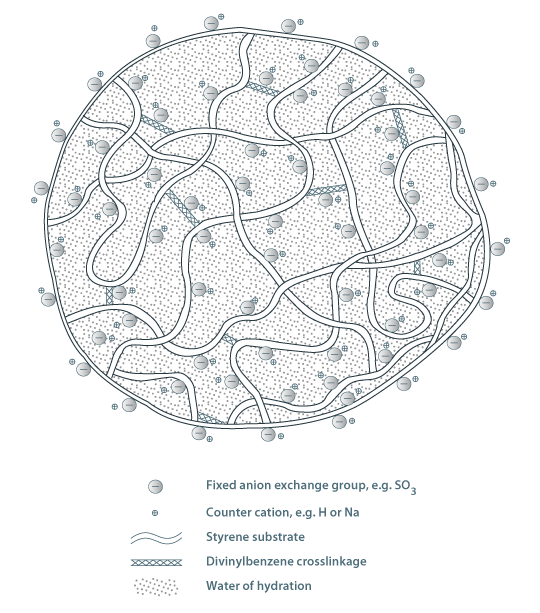
Figura 2 – Modelo de uma resina de permuta iónica.
::: Início :::
2 – Equipamento. Adsorventes e resinas permutadoras de iões mais comuns
A unidade tecnológica mais correntemente usada à escala industrial para processos de adsorção e permuta iónica consiste em colunas cilíndricas, como se mostra na Figura 3, com enchimento de partículas esféricas de adsorvente ou resina (fase estacionária), através das quais passa o fluido a tratar (fase móvel). O ciclo de funcionamento baseia-se normalmente em duas colunas ou leitos fixos em série como ilustra a Figura 4, de forma que enquanto uma está a ser saturado, uma segunda está a ser regenerada. Durante a fase de saturação, a fase móvel a tratar atravessa a coluna e os solutos nela contidos são retidos pela fase estacionária. Após a saturação, é necessário regenerar o adsorvente (resina) utilizando um electrólito forte, permitindo deste modo, que este seja novamente reutilizado.

Figura 3 – Instalação industrial com colunas de carvão activado, Fonte: Triveni – Engineering & Industries LTD - http://www.thewatertreatmentplant.com/
carbon-adsorption.html.

Figura 4 – Esquema com 2 colunas de leito fixo para saturação/regeneração.
Os adsorventes mais comuns utilizados à escala industrial são o carvão activado, a sílica-gel, a alumina activada e os peneiros moleculares. Os três primeiros, usualmente designados por adsorventes amorfos, apresentam áreas específicas entre 200 e 1200 m2/g e uma distribuição de tamanhos de poros alargada. Os peneiros moleculares apresentam tamanhos de poros exactos definidos pela sua estrutura cristalina.
O carvão activado foi um dos primeiros adsorventes conhecidos e é um dos mais utilizados actualmente. Geralmente é produzido a partir da decomposição térmica controlada de material carbonáceo (casca da madeira, de coco, de arroz, carvão, ossos de animais, etc.), a temperaturas inferiores a 600 Cº, seguida pela activação que visa submeter o material carbonizado a reacções secundárias, tendo como finalidade o aumento da área superficial. A activação física é feita com vapor de água, ar ou outro agente oxidante, enquanto que a activação química envolve a impregnação de agentes desidratantes como ácido fosfórico, hidróxido de potássio e cloreto de zinco a temperaturas superiores a 300 Cº. As principais características são as seguintes: área específica = 600 – 1200 m2/g, massa específica = 0.4 g/cm3, porosidade = 0.6 -0.85 e diâmetro médio dos poros = 29 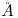 .
.
A sílica gel obtém-se quando se acidifica uma solução de silicato de sódio a uma temperatura de cerca de 360º. O material obtido é altamente poroso e tem como principais aplicações a secagem de correntes gasosas e a separação de hidrocarbonetos aromáticos. Neste tipo de adsorventes a área específica varia entre 600 a 800 m2/g.
A alumina activada prepara-se a partir do aquecimento a cerca de 400 Cº de hidratos de alumina originando um adsorvente com área específica entre 200 a 500 m2/g. A sua aplicação industrial é a desidratação de gases e purificações específicas de correntes líquidas.
Os peneiros moleculares são materiais conhecidos pela designação genérica de zeólitos e consistem em estruturas cristalinas de alumino-silicatos, de ocorrência natural ou preparados em laboratório. A principal vantagem sobre os adsorventes tradicionais é que os zeólitos podem ser feitos por medida para determinadas aplicações na biotecnologia, indústria petroquímica, indústria farmacêutica e na área do ambiente. Como desvantagens pode-se apontar a sua fraca resistência mecânica e instabilidade na presença de soluções ácidas.
As resinas permutadoras de iões são polímeros reticulados, tendo geralmente como matriz o poliestireno, que é um material plástico solúvel em vários solventes. O agente reticulante é o divinilbenzeno (DVB) que torna o material insolúvel e consoante a quantidade presente na estrutura, determina a porosidade da matriz, o grau de inchamento (“swelling”) e a mobilidade de iões na resina. À matriz são fixados grupos funcionais iónicos, por exemplo, ácido sulfónico, o grupo amino quaternário, quelantes, etc. Dependendo do tipo de grupo funcional, as resinas podem ser do tipo ácido (resinas catiónicas) ou do tipo base (resinas aniónicas), forte ou fraca. Na Tabela 1 estão indicados tipos de permutadores de iões que comummente são utilizados em variadas aplicações industriais.
Tabela 1 – Classificação de resinas de permuta iónica mais comuns
| Tipo de resina | Grupo funcional |
| Catiónica do tipo ácido forte | Sulfónico: R-SO3 H |
| Catiónica do tipo ácido fraco | Carboxilíco: R – COOH |
Aniónica do tipo I base forte
Aniónica do tipo II base forte
Aniónica do tipo base fraca | Amino: R-N + (CH 3 )3 Cl –
R-N + (CH 3 )2 (CH 2 )2 OH Cl
R-N + (CH 3 )2 |
| Complexantes | R-SH
R-CH2 N(CH2 COOH)2
R-CH2 NHCH2 CH2 PO3 H |
::: Início :::
3 – Equilíbrio de adsorção e de permuta de iões
A partição do soluto entre a fase fluida e a fase adsorvida envolve um equilíbrio de fases baseado em princípios termodinâmicos. A maneira mais comum de descrever este equilíbrio é expressar a quantidade de soluto adsorvido por quantidade de adsorvente (q) em função da concentração do soluto em solução (C) à temperatura constante. Uma expressão deste tipo designa-se por isotérmica de adsorção.
A metodologia experimental para determinar isotérmicas consiste em colocar em contacto com a solução de concentração conhecida diferentes massas de adsorvente até atingir o equilíbrio. Após a separação do sobrenadante por filtração, avalia-se quantitativamente a quantidade de soluto adsorvido e a concentração de equilíbrio em solução. A representação gráfica de q vs C podem apresentar-se de várias formas (ver Figura 5) e constitui informação relevante para o processo de adsorção em coluna.
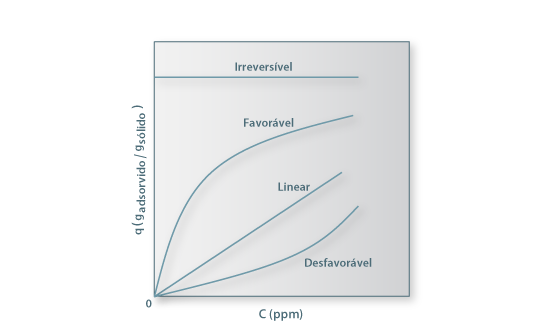
Figura 5 – Isotérmicas de adsorção mais comuns
A isotérmica linear é uma característica de superfícies de adsorventes bastante homogéneas e normalmente ocorre para baixas concentrações da solução. A isotérmica favorável ocorre frequentemente e a desfavorável é típica de superfícies heterogéneas. A isotérmica irreversível, caracterizada por um aumento inicial muito abrupto, traduz uma elevada afinidade do adsorvente para o soluto.
O equilíbrio de permuta iónica é descrito por uma equação química do tipo,
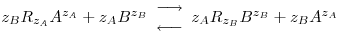 | (1) |
A constante de equilíbrio, ou coeficiente de selectividade, pode ser definida como,
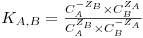 | (2) |
onde,
KA,B – constante de equilíbrio ou coeficiente de selectividade;
CA, CB – Concentração de equilíbrio das espécies A e B na solução;
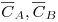 - Concentração de equilíbrio das espécies A e B na resina;
- Concentração de equilíbrio das espécies A e B na resina;
zA, zB – valência iónicas das espécies A e B.
Para iões monovalentes e definindo as seguintes concentrações normalizadas,
- Concentração normalizada do soluto na solução, 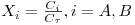
- Concentração normalizada do soluto na resina, 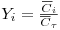
em que, 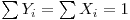 , obtém-se:
, obtém-se:
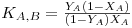 | (3) |
Explicitando YA da equação (3), vem:
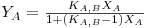 | (4) |
Na Figura 6, mostra-se a representação gráfica da equação (4) para diferentes valores da constante de equilíbrio KA,B. Daí se conclui que valores de KA,B < 1 conduzem a isotérmicas desfavoráveis, enquanto que valores de KA,B superiores à unidade originam isotérmicas favoráveis.
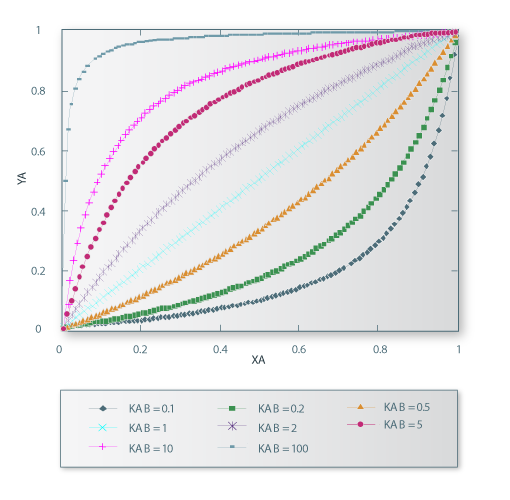
Figura 6 – Efeito da constante K_AB no equilíbrio de permuta de iões monovalentes.
::: Início :::
4 – Cinética de adsorção e operação em leito fixo
As leis cinéticas permitem estudar o comportamento do processo em regime transiente, ou seja, em condições de não-equilíbrio, durante o qual se desenvolvem perfis de concentração do soluto através do filme da interface sólido / fluido e no interior das partículas do adsorvente. Podem distinguir-se 4 etapas sucessivas de transferência de massa: i) transferência no seio da solução para o filme ao redor da partícula; ii) transferência através do filme (difusão externa); iii) transferência através da estrutura de poros do adsorvente (difusão interna) e que, pode combinar a difusão molecular através do fluido contido no interior dos poros e a difusão ao longo da superfície do adsorvente e iv) adsorção sobre a superfície interna intraparticular envolvendo diferentes mecanismos, tais como, adsorção física, adsorção química, permuta iónica, complexação e precipitação química.
A cinética é importante para efeitos de projecto e optimização das colunas de leito fixo. Existem diferentes modelos matemáticos que se podem ajustar aos dados experimentais obtidos em adsorvedores do tipo batch ou do tipo CSTR, proporcionando assim a avaliação dos parâmetros de transferência de massa, ou seja, do coeficiente de transferência de massa e dos coeficientes de difusão intraparticular.
A análise da operação em leito fixo com vista ao dimensionamento de colunas de adsorção ou de permuta iónica baseia-se na curva de saturação (“breakthrough curves”) do adsorvente cuja representação gráfica se mostra na Figura 7. O ponto de ruptura ou “breakpoint”, tBp é definido como o instante em que o soluto é detectado à saída da coluna (Cc ≈ 5% Co) e o tempo de exaustão tE ocorre quando a concentração Cd corresponde a 95 % da concentração inicial. Na situação ideal, i.e., na ausência de resistências à transferência de massa, a resposta da coluna seria um degrau posicionado em t = tSt (tempo estequiométrico). Nesse instante, podemos escrever o seguinte balanço material:
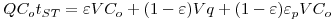 | (5) |
onde,
Q é o caudal volumétrico, Co é a concentração de entrada, V é o volume total do leito, ε é a porosidade interparticular e εp é a porosidade intraparticular.
Rearranjando a equação (5) e introduzindo os parâmetros tempo de residência ou tempo espacial
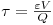
e o factor de capacidade
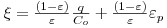 ,
,
vem:
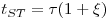 | (6) |
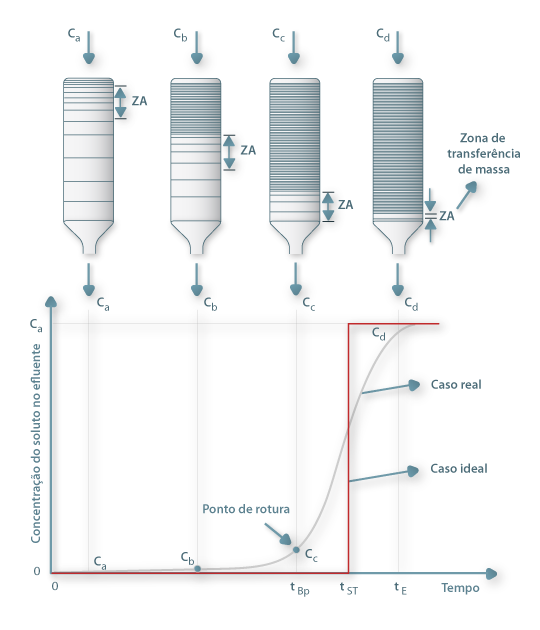
Figura 7 – Curva típica de saturação de adsorventes em leito fixo.
A saturação do soluto no caso ideal pode ser prevista através da aplicação da teoria do movimento do soluto que admite condições de equilíbrio local entre a fase móvel e a fase estacionária e dispersão axial desprezável – escoamento pistão. Sendo assim, a velocidade da onda de concentração que se propaga através da coluna uc é proporcional à fracção de soluto na fase móvel:
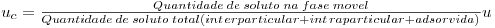 | (7) |
em que u é a velocidade superficial. O soluto deverá acumular-se na fase interparticular εSΔCΔZ, na fase intraparticular (1-ε)??εp?SΔCΔZ e na fase adsorvida (1-ε)??εp ?SΔqΔZ, sendo S a a área da secção recta da coluna e ΔZ a fracção de leito considerado. Ora, reescrevendo a equação (7) e aplicando uma perturbação infinitesimal na concentração do soluto à entrada da coluna, obtém-se
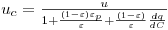 | (8) |
Se a isotérmica é desfavorável, 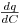 aumenta com a concentração, isto quer dizer que concentrações elevadas se deslocarão à velocidade inferior às das concentrações baixas e a onda torna-se cada vez mais “dispersiva”. Se a isotérmica é desfavorável
aumenta com a concentração, isto quer dizer que concentrações elevadas se deslocarão à velocidade inferior às das concentrações baixas e a onda torna-se cada vez mais “dispersiva”. Se a isotérmica é desfavorável 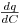 , diminui quando a concentração aumenta e consequentemente, neste caso, forma-se uma onda “compressiva” ou de “choque”.
, diminui quando a concentração aumenta e consequentemente, neste caso, forma-se uma onda “compressiva” ou de “choque”.
A curva de saturação C vs t permite calcular a quantidade total adsorvida,
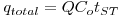 | (9) |
onde
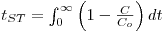 | (10) |
A fracção de leito saturado (FLS) no ponto de rotura pode obter-se pela equação,
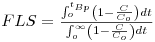 | (11) |
O cálculo rigoroso de colunas de adsorção e de permuta iónica implica a previsão da curva de saturação (“breathrough curve”) com modelos matemáticos que incorporam a equação de conservação de matéria na coluna, relações de equilíbrio, relações cinéticas e condições iniciais e aos limites do problema. Para inteirar-se das equações envolvidas neste cálculo, deve consultar a secção do portal “modelos usados nos simuladores”.
::: Início :::
Bibliografia
- Coulson, J.M. and Richardson, J.F., “Chemical Engineering”, Vol. III, Pergamon Press, 1985
- Ruthven, D.M., “Principles of adsorption and adsorption processes”, John Wiley & Sons, 1984
- Wankat, P.C., “Rate-Controlled Separations”, Blackie Academic & Professional, London, 1994
::: Início :::






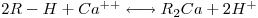



 .
. 
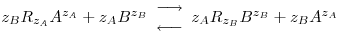
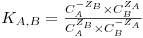
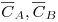 - Concentração de equilíbrio das espécies A e B na resina;
- Concentração de equilíbrio das espécies A e B na resina;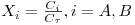
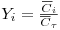
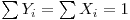 , obtém-se:
, obtém-se: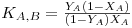
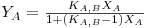

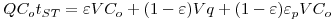
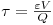
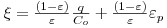 ,
,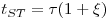

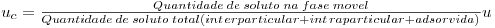
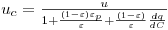
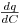 aumenta com a concentração, isto quer dizer que concentrações elevadas se deslocarão à velocidade inferior às das concentrações baixas e a onda torna-se cada vez mais “dispersiva”. Se a isotérmica é desfavorável
aumenta com a concentração, isto quer dizer que concentrações elevadas se deslocarão à velocidade inferior às das concentrações baixas e a onda torna-se cada vez mais “dispersiva”. Se a isotérmica é desfavorável