Diagramas de equilíbrio líquido+vapor
Tipo de problemas do equilíbrio líquido+vapor
Diagramas de equilíbrio líquido+vapor
A representação geométrica do VLE contuma fazer-se em diagramas pressão composição (P, x, y) e (T, x, y) onde x e y designa a composição das fases líquida e gasosa em equilíbrio. Na Figura 1 apresenta-se um diagrama (T, x, y) esquemático de uma mistura binária.
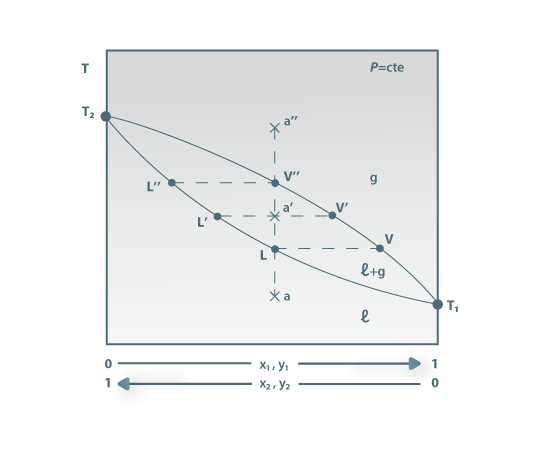
Figura 01: Diagrama (T, x, y) de uma mistura binária de componentes 1 e 2 a pressão constante.
É interessante analisar a sucessão de fenómenos que se observam quando se faz variar a temperatura numa mistura binária a pressão constante. De facto este fenómeno é o cerne das separações líquido/gás. Seja o diagrama (T, x, y) de uma mistura binária de componentes 1 e 2, ilustrado na Figura 1. Na figura os pontos T1 e T2 são respectivamente as temperaturas de vaporização das substâncias puras 1 e 2 à pressão P. Estão indicados os domínios (T, composição) das regiões monofásicas (líquido ou gás) e bifásica (VLE). A curva [T1, V, V`, V”, T2] é a curva dos pontos e orvalho. A curva [T1, L, L´, L”, T2] é a curva dos pontos de ebulição principiante. Considerando a mistura líquida de composição dada pelo ponto a, em que toda a mistura está no estado líquido, considere-se o aquecimento seguindo a linha vertical [a, a”]. A mistura permanecerá no estado líquido até que ao atingir o ponto L, aparece a primeira bolha de vapor: a esta temperatura a composição do líquido é a do ponto L e a composição das bolhas de vapor (a composição da fase gasosa em equilíbrio com o líquido) é a fracção molar dada pela vertical do ponto V. A linha [LV] é uma tie-line já que une pontos que correspondem a fases em equilíbrio. A fase gasosa V é mais rica no componente mais volátil do que a fase líquida L. Continuando a aumentar a temperatura, quando se atinge o ponto a´, as composições do líquido e do vapor em equilíbrio passam a ser dadas pelos pontos L´ e V´, respectivamente. Este aumento de temperatura foi acompanhado duma variação na composição da fase líquida, de L para L´ (ao longo da curva dos pontos de bolha), e duma variação na composição da fase gasosa, de V para V´ (ao longo da curva de orvalho). Se a temperatura for aumentada ainda mais, em V´´ desaparecerá a última gota de líquido (cuja composição é dada pela vertical no ponto L´´). Em a´´ todo o sistema existirá na fase gasosa. Quer dizer: partimos de um sistema inteiramente na fase líquida (no ponto a) e, por aquecimento isobárico, chegamos a um sistema (com a mesma composição) totalmente gasoso (no ponto a´´). Entre as temperaturas correspondentes às isotérmicas [LV] e [L´´ V´´] os sucessivos aumentos de temperatura dão origem a duas fases, líquido e vapor, em equilíbrio, mas de diferente composição. É neste facto que se fundamenta a separação de misturas voláteis por destilação.
::: Início :::
Tipo de problemas do equilíbrio líquido+vapor
A condição geral de equilíbrio termodinâmico em sistemas heterogéneos fechados com c componentes, é a condição de igualdade das fugacidade fi do componente i genérico em todas as fases do sistema:
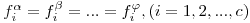
| (1) |
onde α, β ... φ designam as fases do sistema. A fugacidade pode ser calculada a partir de uma equação de estado ou de modelos apropriados para o efeito.
O cálculo do equilíbrio líquido+vapor consiste em resolver as eqs. (1) por forma a encontrar os valores das variáveis termodinâmicas que funcionam como incógnitas do problema, a partir das propriedades que se conhecem à partida. As situações neste tipo de cálculos, de acordo com os dados e as incógnitas de cada caso específico são as seguintes:
- BUBLP - cálculo dos valores da pressão de equilíbrio, P, e da composição do vapor, yi, sendo dadas a temperatura, T, e a composição do líquido, xi;
- BUBLT - cálculo de T e yi sendo os dados P e xi;
- DEWP - cálculo de P e xi , partindo do conhecimento de T e yi;
- DEWT - cálculo de T e xi, sendo os dados P e yi.
- FLASH - cálculo das composições do líquido ( xi ) e do vapor (yi) em equilíbrio, conhecendo à partida P e T, a composição global (l+g) e a quantidade total de substância no sistema.
A fugacidade fi do componente i genérico é, em regra, uma função analiticamente complexa de P, T, xi ou P, T, yi.
::: Início :::