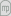Aplicações a casos de estudo
1. Ciclohexano (A) - Água (B) - Etanol (C)
2. Água (A) – Éter di-isopropílico (B) – Ácido Acético (C)
3. Água (A) – Acetato de Etilo (B) – Etanol (C)
Aplicações a casos de estudo
Uma vez que o simulador Extracção está limitado ao caso de solvente (B) e diluente (A) completamente imiscíveis, é necessário verificar a aplicabilidade deste pressuposto aos sistemas estudados, e só depois utilizar o simulador para analisar e projectar o processo de extracção.
::: Início :::
1. Ciclohexano (A) - Água (B) - Etanol (C)
Suponhamos que se pretende projectar um equipamento para extrair o etanol (C) presente numa mistura de etanol (C) e ciclohexano (A), usando água (B) como solvente. A Tabela 1 apresenta dados experimentais de equilíbrio líquido-líquido para este sistema. O respectivo diagrama ternário encontra-se na secção Equilíbrio líquido-líquido/Aplicações e casos de estudo.
Tabela 1. Composição (em fracções mássicas) das fases de extracto e resíduo em equilíbrio para o sistema ciclohexano (A) - água (B) - etanol (C), a 1 bar e 25 ºC(a).
| Extracto | Resíduo |
| C | A | B | C | A | B |
| 0.000 | 0.000 | 1.000 | 0.000 | 1.000 | 0.000 |
| 0.064 | 0.000 | 0.936 | 0.002 | 0.987 | 0.011 |
| 0.125 | 0.000 | 0.875 | 0.007 | 0.984 | 0.009 |
| 0.164 | 0.000 | 0.836 | 0.011 | 0.975 | 0.014 |
| 0.225 | 0.001 | 0.774 | 0.017 | 0.975 | 0.008 |
| 0.274 | 0.003 | 0.723 | 0.026 | 0.964 | 0.010 |
| 0.332 | 0.005 | 0.663 | 0.027 | 0.963 | 0.010 |
| 0.418 | 0.012 | 0.57 | 0.038 | 0.953 | 0.009 |
| 0.489 | 0.026 | 0.485 | 0.051 | 0.944 | 0.005 |
a Mariyoshi, T., et. al., J. Chem. Thermodynamics, 23, 37-42 (1991).
Para a gama de concentrações dos dados experimentais, o extracto contém pequenas quantidades do diluente A (xA máximo é igual a 0.026) e o resíduo pequenas quantidades do solvente B (xB máximo é apenas 0.014). Sendo assim, a aproximação de A e B imiscíveis é muito razoável, podendo projectar-se o extractor com base nela. Os dados de equilíbrio podem então ser expressos na forma y = f(x), onde x é a fracção mássica de C no resíduo (contendo apenas A e C) e y a fracção mássica de C no extracto (contendo apenas B e C). Os pontos experimentais são razoavelmente ajustados pelo polinómio do 2º grau: y = -89.035x2 + 13.951x + 0.019764 (obtido por mínimos quadrados), válido para x<~0.05, tal como se mostra na Figura 1. O 6º ponto experimental é excluído do ajuste. O erro padrão do ajuste (em y) é de 0.012969. Deve notar-se que o ajuste não é bom para valores de x muito baixos.
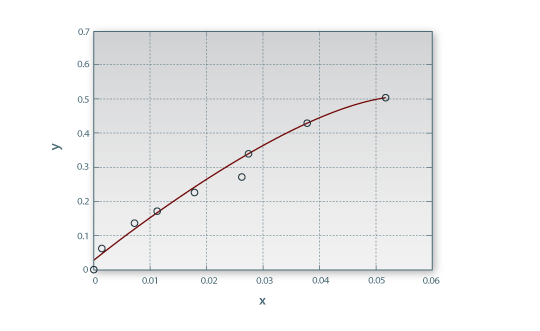
Figura 1. Ajuste quadrático dos dados experimentais.
Com base na equação de equilíbrio acima calculada, pode agora projectar-se um extractor em múltiplos andares, usando o simulador Extracção. Considera-se uma alimentação com caudal F = 100 kg/h, contendo 5% em massa de etanol (x0 = 0.05) e uma corrente de solvente puro (yN+1 = 0), com um caudal S = 10 kg/h.
Comecemos por especificar uma recuperação de 90% de etanol na corrente de extracto. Em primeiro lugar, o programa calcula o caudal e composição das correntes de saída, tal como se segue. A corrente de extracto contém 90% do etanol presente na alimentação mais todo o componente B existente em S, uma vez que A e B não se misturam. Então, o caudal de extracto é E1 = 0.9×5 + 10 = 14.5 kg/h e a fracção mássica de etanol no extracto é y1 = 0.9×5/14.5 = 0.3103. Para a corrente de resíduo, tem-se: RN = 95.5 kg/h e xN = 0.5/95.5 = 0.005236. De seguida, o programa determina o número de andares de equilíbrio necessários à extracção, utilizando um método semelhante ao método de McCabe-Thiele para destilação. Os cálculos são feitos utilizando coordenadas isentas de soluto, o que faz com que a linha operatória seja linear. Para a alimentação e correntes de resíduo, usa-se X = x/(1-x) e para o solvente e correntes de extracto, Y = y/(1-y), sendo x e y fracções mássicas de soluto. Por exemplo, para a alimentação, X0 = 0.05/0.95 = 0.05263.
A Figura 2 mostra o diagrama XY de projecto, incluindo a linha de equilíbrio, a linha operatória e o traçado dos vários andares de equilíbrio. Ao fim de 3 andares, a concentração de soluto no resíduo é inferior ao valor desejado (X3 = 0.002290 < XN = 0.005263), pelo que são necessários entre 2 e 3 andares. Com base nos valores de X2 e X3 e por interpolação linear, obtém-se N = 2.7. Estes e outros resultados encontram-se registados no relatório produzido pelo simulador.
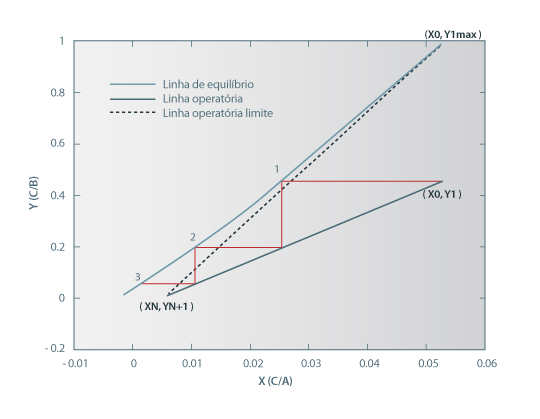
Figura 2. Diagrama XY para uma recuperação de soluto de 90%.
O simulador calcula também o caudal de solvente mínimo (neste caso, apenas 4.6 kg/h) e traça no diagrama XY a linha operatória correspondente a este limite de operação, para o qual o número de andares é infinito. O ponto de estrangulamento, onde a linha operatória e a linha de equilíbrio se encontram, pode corresponder à alimentação (como acontece neste caso) ou pode ocorrer para X < X0, dependendo do formato da linha de equilíbrio.
Consideremos agora que pretendemos mais do nosso extractor, exigindo uma recuperação de 98%. O simulador calcula agora que são necessários 4.5 andares, representando-se na Figura 3 o respectivo diagrama XY. Note-se que neste caso o ponto de estrangulamento ocorre antes da alimentação, ou seja, para X < X0.
Figura 3. Diagrama XY para uma recuperação de soluto de 98%.
Podemos ainda usar o simulador Extracção no modo de simulação, ou seja, especificar o número de andares da coluna de extracção. O programa calcula então a recuperação de soluto correspondente. Para N = 2 andares, a recuperação é de 84.2%, representando-se na Figura 4 o diagrama XY respectivo. Neste modo de cálculo, podemos estudar, por exemplo, o efeito da variação do caudal de solvente na recuperação, para um número de andares constante. Aumentando o caudal de solvente, o declive da recta operatória diminui, conseguindo-se com o mesmo número de andares um resíduo mais isento de soluto e logo uma maior recuperação deste no extracto. Por exemplo, para S = 20 kg/h, a recuperação aumenta para 95.6%.
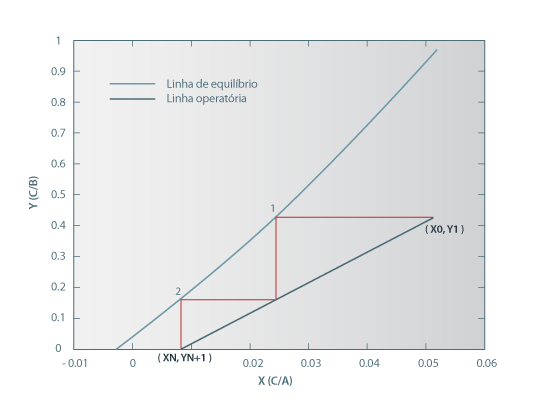
Figura 4. Diagrama XY para 2 andares de equilíbrio.
Questões propostas
1. Para as condições da Figura 2, estude o efeito do caudal de solvente no número de andares necessário à extracção (recuperação de soluto fixa em 90%).
2. Para as condições da Figura 2, estude o efeito da contaminação do solvente com soluto no número de andares necessário à extracção (S = 10 kg/h e recuperação de soluto fixa em 90%).
3. Para as condições da Figura 3, qual a contaminação máxima do solvente com soluto, de modo à operação ainda ser possível (S = 10 kg/h e recuperação de soluto fixa em 98%).
4. Para as condições da Figura 4, calcule o caudal de solvente necessário para que se recupere 99% do soluto numa coluna com 2 andares de equilíbrio.
5. Suponha agora que se pretende projectar uma coluna de extracção para tratar uma alimentação mais rica em etanol, com 10% em massa deste composto. Será razoável efectuar o projecto com a curva de equilíbrio da Figura 1?
::: Início :::
2. Água (A) – Éter di-isopropílico (B) – Ácido Acético (C)
A Tabela 2 apresenta dados experimentais de equilíbrio líquido-líquido para este sistema. Neste caso, a aproximação do extracto e resíduo a correntes binárias é razoável para misturas diluídas no soluto, mas torna-se grosseira para misturas com elevado teor de soluto. Considera-se que o modelo pseudobinário é razoável para a gama de concentrações correspondente aos 6 primeiros pontos experimentais (a sombreado na tabela), uma vez que nessa gama as concentrações de A no extracto e B no resíduo são ambas inferiores a 5%. Estes 6 pontos experimentais são bem descritos pelo polinómio do 2º grau: y = 0.70828x2 + 0.26376x – 0.00028492, válido para x <~ 0.26, tal como se mostra na Figura 5. Note-se que x é a fracção mássica de C no resíduo (contendo apenas A e C) e y a fracção mássica de C no extracto (contendo apenas B e C). O erro padrão do ajuste (em y) é de apenas 0.00040291.
Tabela 2. Composição (em fracções mássicas) das fases de extracto e resíduo em equilíbrio para o sistema água (A) – éter di-isopropílico (B) – ácido acético, a 1 atm e 20 ºC(a).
| Extracto | Resíduo |
| B | A | C | B | A | C |
| 0.9932 | 0.005 | 0.0018 | 0.012 | 0.9811 | 0.0069 |
| 0.9893 | 0.007 | 0.0037 | 0.015 | 0.9709 | 0.0141 |
| 0.9841 | 0.008 | 0.0079 | 0.016 | 0.9551 | 0.0289 |
| 0.9707 | 0.01 | 0.0193 | 0.019 | 0.9168 | 0.0642 |
| 0.9328 | 0.019 | 0.0482 | 0.023 | 0.844 | 0.133 |
| 0.847 | 0.039 | 0.114 | 0.034 | 0.711 | 0.255 |
| 0.715 | 0.069 | 0.216 | 0.044 | 0.589 | 0.367 |
| 0.581 | 0.108 | 0.311 | 0.106 | 0.451 | 0.443 |
| 0.487 | 0.151 | 0.362 | 0.165 | 0.371 | 0.464 |
a Treybal, R. E., Mass-Transfer Operations, McGraw-Hill, 3ª ed., 494-496 (1980).
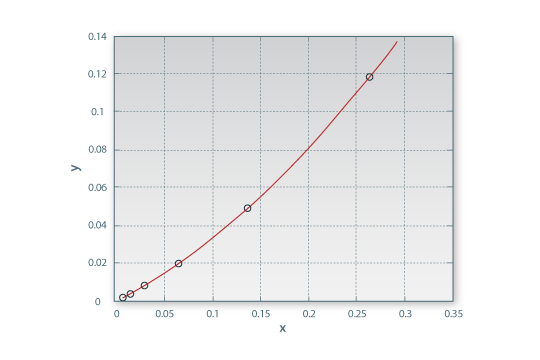
Figura 5. Ajuste quadrático dos dados experimentais.
Com base na equação de equilíbrio acima calculada, vamos agora considerar o seguinte problema de extracção. Uma coluna, a operar em contra-corrente, extrai o ácido acético (C) presente numa solução aquosa (A+C) com 30% em massa de ácido, usando éter di-isopropílico (B) como solvente. O caudal de alimentação é 100 kg/h e para um caudal de solvente também de 100 kg/h, contaminado com 2% de ácido acético, obtém-se 114 kg/h de extracto, o que corresponde a uma baixa percentagem de recuperação do soluto. Que alterações podem ser feitas ao sistema, de modo a aumentar-se a recuperação do soluto?
Em primeiro lugar, deve notar-se que a concentração de soluto na alimentação (x0 = 0.3) está acima do limite superior de validade da equação de equilíbrio (~0.26). Os resultados abaixo obtidos serão criticados tendo isto em atenção. Por agora, avancemos com a análise do problema.
Começamos por calcular a percentagem de recuperação do soluto correspondente aos dados conhecidos. Sendo A e B imiscíveis, o caudal de extracto é igual ao caudal de solvente introduzido mais a quantidade de C extraída. Deste modo, a percentagem de recuperação do soluto é 14/30 = 46.7%. Usando o simulador Extracção, esta recuperação corresponde a uma coluna com 6.3 andares. Na Figura 6, apresenta-se o diagrama XY para esta coluna.
Podemos agora verificar se a curva de equilíbrio foi ou não demasiado extrapolada. O valor máximo de X é X1 = 0.4222, que corresponde a x1 = 0.2969 > 0.26. Portanto, a curva de equilíbrio foi ligeiramente extrapolada, mas, atendendo à Figura 5, o valor de y previsto parece ser razoável. Podemos então avançar com a análise dos resultados e procurar alterações que melhorem o desempenho da extracção.
Como se pode observar na Figura 6, o sistema está perto do estrangulamento, sendo os primeiros andares de equilíbrio muito pouco eficientes (por outras palavras, o caudal de solvente é muito próximo do mínimo, que é igual a 98.0 kg/h). Deve então aumentar-se o caudal de solvente, de modo a melhor rentabilizar os primeiros andares da coluna. Para um caudal de solvente duplo do inicial (S = 200 kg/h), e com os mesmos 6.3 andares, o simulador prevê um aumento da recuperação para 74.0%. Na posse de mais dados, deve averiguar-se se este aumento da eficácia da extracção é compensador face ao aumento de custos com o solvente.
Outro aspecto do processo que pode ser explorado é a pureza do solvente, até agora considerado com 2% de soluto. Quanto mais puro for o solvente, mais eficiente será a extracção. Partindo da corrente S, com 200 kg/h e 2% de soluto, e supondo que se consegue uma separação perfeita entre B e C, então obtém-se 196 kg/h de solvente puro. Com este solvente, a percentagem de recuperação, para os mesmos 6.3 andares, aumenta para 85.3%. A análise económica desta alternativa envolve agora averiguar se o maior rendimento da extracção compensa os custos envolvidos na purificação do solvente.
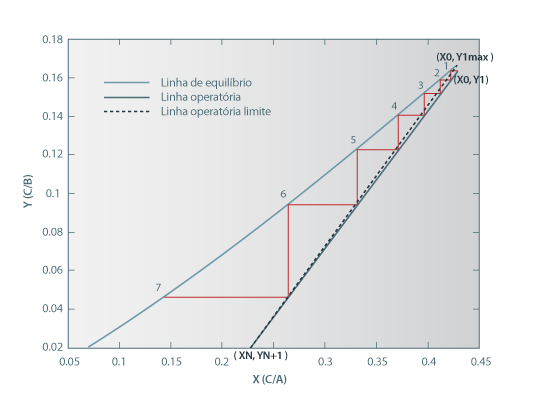
Figura 6. Diagrama XY para a coluna a operar com 100 kg/h de solvente.
Outra hipótese que pode ainda ser analisada, de modo a aumentar o rendimento da extracção, é a substituição do solvente por outro de maior selectividade, conseguindo-se assim condições de equilíbrio líquido-líquido mais favoráveis à extracção. Pesquise na literatura um tal solvente, começando por procurar entre os compostos da base de dados do simulador LLE .
::: Início :::
3. Água (A) – Acetato de Etilo (B) – Etanol (C)
Os dados experimentais de equilíbrio líquido-líquido para este sistema encontram-se na Tabela 3 abaixo. Neste caso, apesar do resíduo arrastar pouco solvente (B), o extracto contém quantidades muito significativas de água (A), e logo a aproximação de A e B imiscíveis não é de modo nenhum razoável. Como tal, o projecto do processo de extracção não pode ser baseado nessa aproximação, o que inviabiliza a utilização do simulador Extracção. Sendo assim, há que recorrer a métodos que tratem explicitamente as correntes de extracto e resíduo como ternárias, como por exemplo o método gráfico de projecto baseado no diagrama ternário de equilíbrio líquido-líquido.
Tabela 3. Composição (em fracções molares) das fases de extracto e resíduo em equilíbrio para o sistema água (A) – acetato de etilo (B) – etanol (C), a 1 atm e 25 ºC(a).
| Extracto | Resíduo |
| B | C | A | B | C | A |
| 0.867 | 0 | 0.133 | 0.022 | 0.000 | 0.978 |
| 0.796 | 0.035 | 0.169 | 0.026 | 0.021 | 0.953 |
| 0.753 | 0.056 | 0.191 | 0.026 | 0.031 | 0.943 |
| 0.661 | 0.093 | 0.246 | 0.029 | 0.048 | 0.923 |
| 0.573 | 0.122 | 0.305 | 0.032 | 0.062 | 0.906 |
| 0.432 | 0.156 | 0.412 | 0.042 | 0.082 | 0.876 |
a Arce, A., Alonso, L. e Vidal, I., Journal of Chemical Engineering of Japan, 32 (4), 440-444 (1999).
::: Início :::